NIBS邵峰最新发表Cell文章:利用沙门氏菌效应蛋白揭示异源自噬机制
真核细胞通过选择性自噬的方式识别胞内病原体的过程称为异源自噬(xenophagy)。异源自噬在宿主天然免疫防御中发挥重要作用。关于异源自噬发生的分子机制一直是领域内研究的热点问题。虽然已有众多假说被提出,但由于现有模型中异源自噬发生比例低等问题的存在,使得人们很难判断假说的正确性。
来自北京生命科学研究所的研究人员发表了题为“A Bacterial Effector Reveals the V-ATpase-ATG16L1 Axis that Initiates Xenophagy”的文章,报道沙门氏菌编码的效应蛋白SopF可以特异抑制异源自噬,敲除sopF基因后沙门氏菌可高效诱导异源自噬的发生。以此为突破口,鉴定出V-ATpase是感知细菌感染的关键蛋白,通过招募自噬蛋白ATG16L1介导异源自噬的启动。为真核细胞如何识别胞内细菌并触发自噬通路提供全新的分子机制。
这一研究成果公布在7月18日的Cell杂志上,由NIBS邵峰研究员领导完成,第一作者为许悦。
沙门氏菌经常被用作研究异源自噬机制的生物模型。然而, 人们很早就注意到, 侵入宿主细胞内的沙门氏菌仅在感染早期有少量细菌会被细胞自噬识别。除了研究宿主细胞中的天然免疫通路,邵峰实验室也长期致力于研究细菌效应蛋白抑制宿主的免疫识别过程。于是研究者猜想沙门氏菌中可能存在抑制异源自噬的效应蛋白。
通过沙门氏菌转座子遗传筛选,研究人员发现一个全新的沙门氏菌III型分泌系统(T3SS)效应蛋白,SopF,可以抑制异源自噬。sopF基因的敲除使得细菌被自噬识别的水平提高至80%。另外,研究者还发现,在真核细胞外源表达SopF可抑制不同种类细菌触发的自噬过程,但对于经典自噬通路却没有抑制作用。因此SopF的发现为研究异源自噬通路的机制提供了一个绝佳的突破口。
经过巧妙的实验设计,研究人员利用CRISpR与流式分选技术相结合的方法,筛选出V-ATpase复合物可能参与异源自噬过程。并利用三组平行实验证明了V-ATpase复合物介导异源自噬。在触发异源自噬的条件下,他们检测到V-ATpase复合物招募自噬蛋白ATG16L1至包裹细菌的膜泡结构上,并启动异源自噬。
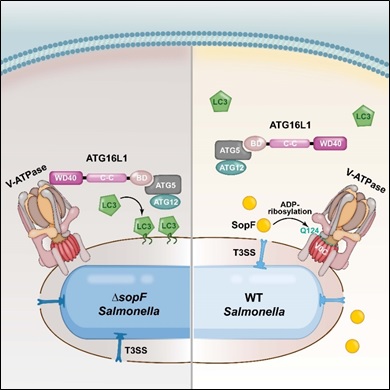
研究人员还证明细菌感染过程中引发的膜泡损伤被V-ATpase感知而结合ATG16L1。V-ATpase与ATG16L1的相互作用依赖于ATG16L1的WD40结构域(这一结构域不参与经典自噬通路,在酵母中也不存在), 并且二者的结合可以被SopF破坏。SopF通过抑制V-ATpase-ATG16L1通路进而促进沙门氏菌在体内的扩散与增殖。
通过解析SopF的晶体结构, 研究人员发现其具有ADp-核糖基转移酶活性。经过巧妙的修饰底物富集的实验设计与质谱鉴定,他们证明SopF可以催化V-ATpase复合物中ATp6V0C亚基的第124位谷氨酰胺发生ADp-核糖基化修饰。将细胞中第124位谷氨酰胺替换为丙氨酸后,V-ATpase与ATG16L1不再能结合,异源自噬过程被完全抑制。
这说明ATp6V0C第124位谷氨酰胺对于细菌触发的V-ATpase-ATG16L1相互作用至关重要,当SopF对其进行修饰或替换为丙氨酸均破坏了异源自噬的发生。
这项研究从沙门氏菌转座子筛选发现异源自噬的抑制蛋白SopF出发,一方面利用宿主细胞的遗传学筛选鉴定到V-ATpase复合物,另一方面通过ADp-核糖基化蛋白组学鉴定出SopF的修饰底物ATp6V0C,最终共同证明V-ATpase-ATG16L1的结合介导异源自噬通路。
宿主细胞巧妙地利用V-ATpase识别细菌感染早期引发的膜泡损伤,激活异源自噬通路;沙门氏菌也进化出高效的应对机制,即通过分泌效应蛋白SopF特异性修饰V-ATpase,阻断自噬蛋白的招募,逃脱宿主细胞的免疫识别(下图)。V-ATpase-ATG16L1的发现为异源自噬的发生机制提供了强有力的实验证据,解答了长期以来关于异源自噬识别的疑问,也为其他选择性自噬通路的研究提供新的实验思路。
原文标题:
A Bacterial Effector Reveals the V-ATpase-ATG16L1 Axis that Initiates Xenophagy