CRISPR小基因方法阻止小鼠遗传性肝病
enn Medicine 研究人员在Science Advances在线发表的新概念验证研究中报告说,一种新的 CRISPR 基因编辑技术预防了已知由数百种不同突变驱动的遗传性肝病,并改善了小鼠的临床症状。研究结果表明,一种很有前途的 CRISPR 工具可能会治疗因酶、鸟氨酸氨甲酰转氨酶 (OTC) 缺乏而导致的罕见代谢性尿素循环障碍患者,以及由同一基因上的不同突变引发的其他遗传性疾病。

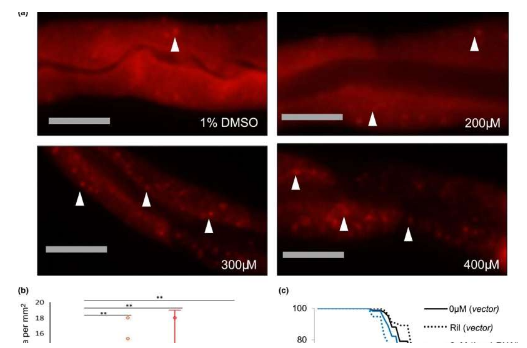
CRISPR 方法建立在 Penn Medicine 之前开发的一种方法的基础上,该方法仅限于纠正一个突变——它有益于新生小鼠而不是成年小鼠。这一次,这项技术——采用一种新型的双腺相关病毒 (AAV) 来传递其成分——在基因组中插入了一个“小基因”,以实现 OTC 在肝细胞中的持续表达,这被称为“剪切”和“粘贴”的方法。没有纠正任何突变,而是将一组新的指令添加到细胞中。结果,研究人员观察到新生小鼠的临床益处持续到成年期。
“就像大多数对新生儿有致命影响的遗传疾病一样,长期有效的早期治疗是必不可少的,”医学教授、基因治疗项目主任、医学博士 James Wilson 说。宾夕法尼亚孤儿疾病中心。“在这里,我们将 CRISPR 方法向前推进,不仅可以维持细胞中 OTC 的表达,还可以扩大该工具的能力。我们的目标是最终将这种基因编辑方法从动物身上转化为治疗患有 OTC 疾病和其他遗传疾病的患者通过分散在整个基因中的突变——而不是单一的、主要的突变。”
在每 40,000 名新生儿中就有一人发现 OTC 疾病可能源于 OTC 基因上的 300 多种不同突变。由于这些突变发生在 X 染色体上,因此通常在男性中发现,而女性是携带者。尿素循环是一系列六种肝酶,可帮助清除体内的氨。当其中一种酶缺失或不足时,氨会在血液中积聚并进入大脑,从而导致脑损伤甚至死亡。为了治疗这种疾病,患者服用药物来刺激替代的氮清除途径,或者在严重的情况下进行肝移植。然而,这些患者的死亡率仍然很高,因此需要更新、更有效的疗法。
为了开发一种广泛适用的基因组编辑工具,该团队构建了一个新的双 AAV 载体,其中包含一种称为 Cas9 的 RNA 引导细菌蛋白——一种在细胞中寻找和操纵基因的快速可靠的方法。被称为 AAV8 的这种宾夕法尼亚大学开发的载体特别对肝细胞具有亲和力。第二个 AAV 包含一个功能齐全的“小基因”,表达密码子优化的人类 OTC(供体 DNA),由肝脏特异性启动子驱动,以确保它在注入血液时仅在肝细胞中表达。