载有干细胞的纳米纤维水凝胶成功治疗克罗恩病的严重并发症
在一项使用克罗恩病大鼠模型的新研究中,由约翰霍普金斯大学医学研究人员与怀廷工程学院合作开发的载有干细胞的可生物降解水凝胶复合材料在治疗肛周瘘管 (PAF) 方面取得了显着成功——克罗恩病的众多并发症之一。
克罗恩氏病是炎症性肠病的一种亚型,据美国疾病控制和预防中心估计,这种疾病折磨着超过 300 万成年美国人。大约 30% 到 40% 的克罗恩病患者会形成肛周瘘管——皮肤和肛门内部之间的发炎隧道。瘘管会导致疼痛、肿胀、不适以及血液或脓液渗漏。通常需要手术来治疗这种情况。然而,超过一半的患者无法从目前可用的治疗中获益。
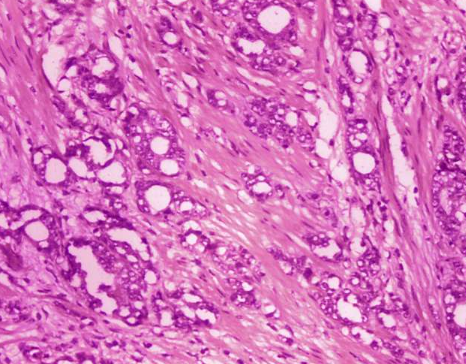
这种可注射、可生物降解、机械破碎的纳米纤维-水凝胶复合材料 (mfNHC) 载有约翰霍普金斯大学团队设计的干细胞,可以注射到瘘管内,并显示出更高程度的愈合,将瘘管的尺寸缩小六倍, 与手术相比。
结果于 1 月 4 日发表在《科学进展》杂志上。
“许多患者在十几岁到二十出头时被诊断出患有克罗恩病,他们正在考虑终生遭受肛周瘘管的折磨,”医学和肿瘤学副教授 Florin M. Selaru 医学博士说;霍普金斯大学 IBD 中心主任和约翰霍普金斯大学 IBD 研究 Atran 教授,也是该研究的资深作者之一。“众所周知,克罗恩病患者的这种病症难以治疗。我们希望这些结果能够提供一种潜在的新治疗范式,以便加以转化并改善这些患者的生活质量。”
Selaru 说,之前的研究和当前的临床试验表明,在瘘管周围注射干细胞有助于局部愈合。然而,干细胞不太可能在瘘道周围保留任何有意义的时间,以允许任何显着愈合。该团队制造的水凝胶可以直接注射到瘘道中。它注入了纳米纤维碎片,使物质具有足够的刚度,可以将干细胞固定在瘘管部位,这样它们就不会迁移。这将有助于组织再生并促进健康愈合。
“将其视为组织再生纳米凝胶-纳米纤维复合材料的局部输送,它还可以将干细胞保持在受伤部位并使愈合得以发生,”Selaru 说。凝胶构建了一个支架,将干细胞保留在瘘管部位并促进再生愈合。结果显示,与手术相比,凝胶的瘘道体积总体减少了六倍。