两项基因组研究可以产生更有效 毒性更小的免疫疗法
开发转化免疫疗法的生物技术公司Mnemo Therapeutics宣布在其最接近的学术合作者居里研究所开发的两项科学研究发表在《科学免疫学》杂志上。这些出版物揭示了TE-外显子剪接连接作为新的复发性癌症特异性靶点的来源,并且对开发更有效和毒性更小的免疫疗法具有潜在意义。研究结果进一步验证了Mnemo的抗原发现平台,该平台是该公司细胞治疗管线的关键驱动力。

“灰色基因组”,也称为黑暗基因组的一部分,被注释,转录,有时被翻译,约占人类基因组总数的45%。这些基因组区域在历史上被忽视,因为它们知之甚少;然而,最近越来越多的证据表明,探测灰色基因组可以通过识别编码癌症特异性靶点的特征来扩展以前未知靶点的潜在领域,这些靶点既具有肿瘤特异性,又由相当大比例的患者共享。
“目前的癌症靶点来自人类基因组的一小部分,这使得具有潜在肿瘤靶点的区域在很大程度上被忽视,”Mnemo Therapeutics首席执行官Robert LaCaze说。“通过挖掘灰色基因组,作者发现了一类全新的癌症抗原,这些抗原在癌症患者中具有高度的肿瘤特异性和复发性。我们不仅渴望更好地了解这些新的肿瘤抗原如何与我们目前的管线协同作用,而且还渴望进一步利用它们作为战略合作伙伴关系的一部分来推进更广泛的免疫肿瘤学领域。
在第一项研究中,由免疫学高级副总裁Sebastian Amigorena博士和Mnemo科学联合创始人,CNRS研究主任兼免疫反应和癌症团队(Institut Curie / Inserm)负责人和Inserm研究员Marianne Burbage博士指导,研究人员确定了来自小鼠肿瘤细胞系中非规范剪接连接的新抗原家族。
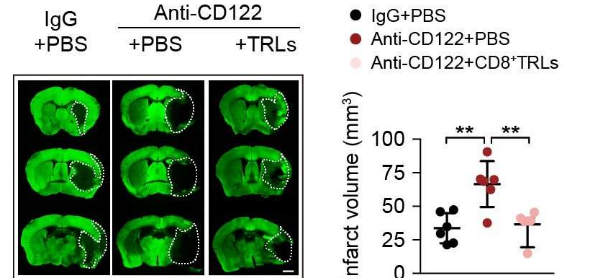
这些抗原在荷瘤小鼠中引发免疫反应,并在将这些肽作为预防或治疗性疫苗施用时成功延迟肿瘤生长。此外,组蛋白甲基转移酶Setdb1的失活导致该抗原家族的表达增加和肿瘤细胞免疫原性(触发阻止肿瘤生长的免疫反应的能力)。
第二项研究由癌症综合功能基因组学团队(Institut Curie/Inserm)负责人Amigorena和Joshua Waterfall博士领导,专门检查了非小细胞肺癌(NSCLC)患者和健康组织样本中的这一抗原家族。研究小组确定了在NSCLC患者中产生免疫原性肽的肿瘤特异性,非规范剪接连接,从而描述了NSCLC癌症患者中复发性肿瘤特异性抗原的新来源。