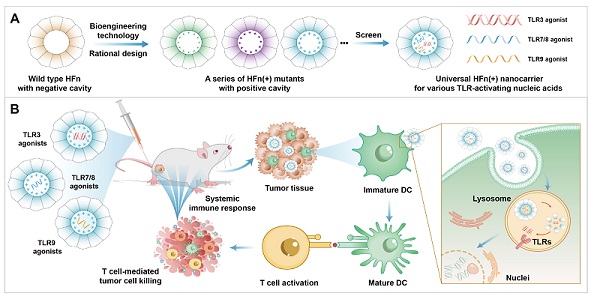
两种突变基因的力量制衡——解锁阿尔兹海默症治疗新方向
插画作者:罗伊·斯科特
因为一种罕见的基因突变,Aliria Rosa piedrahita de Villegas本该在她40多岁的时候患上老年痴呆症,在60多岁的时候死于这种疾病,相反,她一直活到了70多岁,没有患上痴呆症。现在,她的大脑正在提供有关痴呆症病理和阿尔茨海默病可能的治疗方法的重要线索。
正如马萨诸塞州总医院和其他中心的研究人员在2019年首次描述的那样,这名来自哥伦比亚麦德林的女性是一个大家庭的成员,其pSEN1基因发生了突变。pSEN1 E280A突变是常染色体显性的,这意味着只需要该基因的一个拷贝就可以引起疾病。该突变的携带者通常在40岁或50岁时表现出阿尔茨海默病的症状,并在不久后死于该病,但这位妇女直到70岁出头才开始表现出阿尔茨海默病的迹象。她于2020年死于转移性黑色素瘤,享年77岁。
这名哥伦比亚妇女30年来抵御这种疾病的能力的关键区别似乎是,除了pSEN1 E280A突变外,她还携带了ApOE3 Christchurch突变的两个副本。
“这个特殊的案例是大自然设计的一个实验,它教会我们一种预防阿尔茨海默病的方法:让我们观察、学习和模仿大自然,”哥伦比亚安蒂奥基亚神经科学小组主任Francisco Lopera Medellín说。
ApOE家族基因控制载脂蛋白的产生,载脂蛋白在血液和其他体液中运输脂质(脂肪)。众所周知,ApOE2基因变体可以预防老年痴呆症,而ApOE4基因变体则会增加患老年痴呆症的风险。ApOE3是最常见的变异,通常与降低或增加患阿尔茨海默病的风险无关。
他们在神经病理学杂志《神经病理学学报》上所报道,事实上,这名妇女的大脑中确实有阿尔茨海默病的病理特征,但在大脑中通常发现阿尔茨海默病特征的区域中却没有。
“这名患者让我们看到了许多相互竞争的力量——异常的蛋白质积累、炎症、脂质代谢、自我平衡机制——这些要么促进要么保护疾病进展,并开始解释为什么一些大脑区域得以幸免,而另一些则不能,”MGH神经学的共同第一作者、研究员Justin Sanchez说。
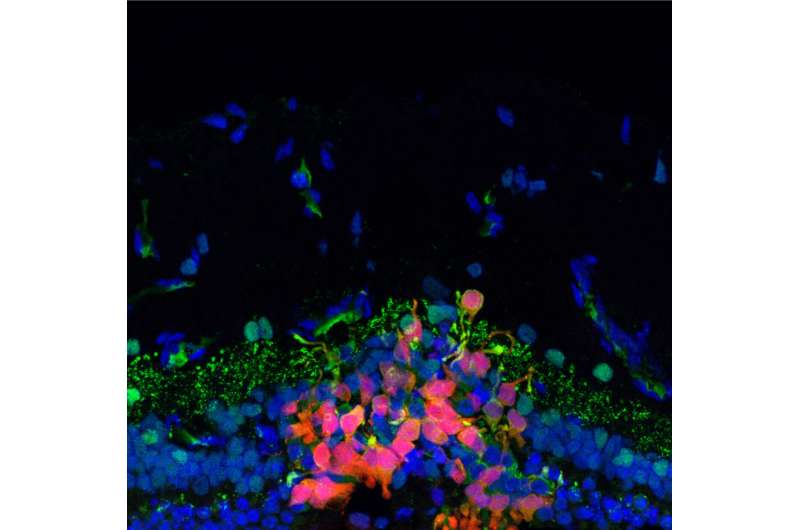
研究人员在Aliria的大脑中发现了一种tau蛋白异常聚集或“结块”的明显模式,这种蛋白在阿尔茨海默病和其他神经疾病中被改变。在这种情况下,tau的病理很大程度上保留了对判断和其他“执行”功能很重要的额叶皮层,以及对记忆和学习很重要的海马体。相反,tau蛋白的病理涉及枕叶皮层,这是大脑后部控制视觉感知的区域。枕叶皮层是唯一表现出典型阿尔茨海默病特征的主要大脑区域,比如被称为小胶质细胞的保护性脑细胞的慢性炎症,以及ApOE表达水平下降。研究人员写道:“因此,基督城变异可能会影响tau病理学的分布,调节发病年龄、严重程度、进展和[常染色体显性阿尔茨海默病]的临床表现,这表明可能的治疗策略。”
“在研究家族性阿尔茨海默病大脑时,我们很少有惊喜。该病例表现出明显的保护表型。我相信我们的分子和病理学发现至少会提出一些研究的途径,并引出成功治疗这种疾病的希望。合著者Diego Sepulveda-Falla说,他是德国汉堡埃彭多夫大学医学中心的研究负责人。