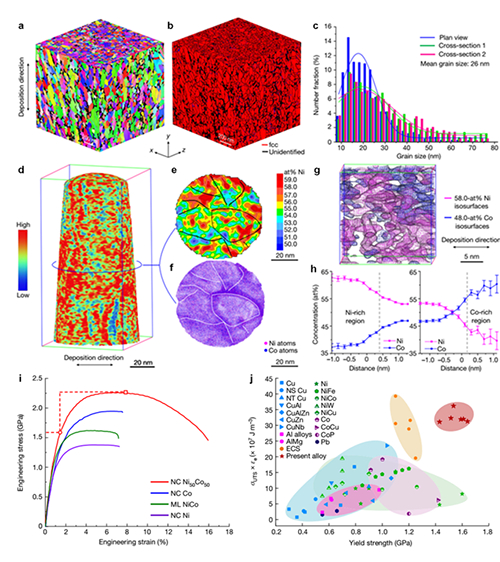
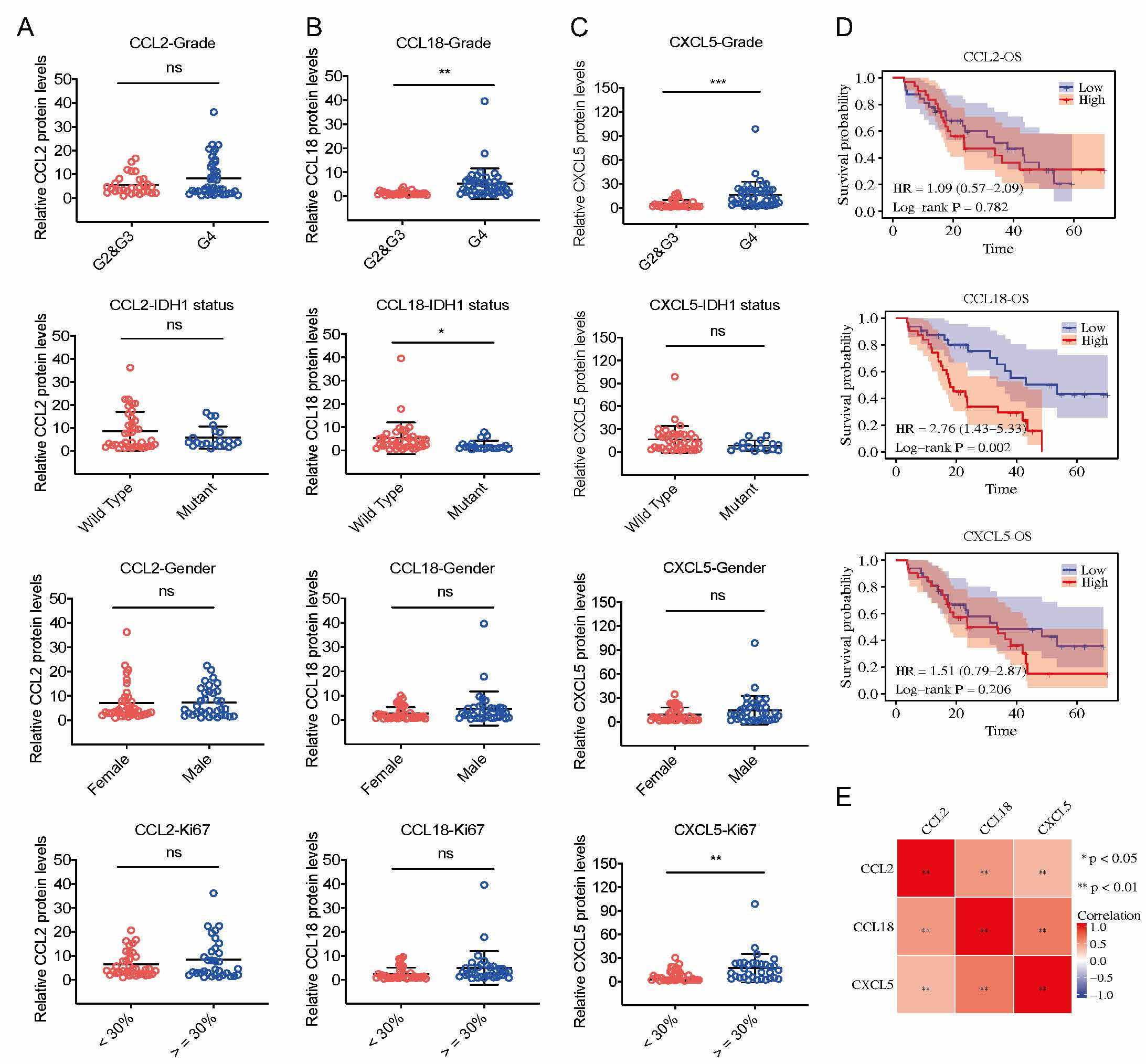
华大研究院揭示新型PylRS/tRNAPyl相互正交的分子机制
利用基因密码子拓展技术向蛋白质定点引入非天然氨基酸,可赋予目标蛋白质新的物理化学性质,为推动人类在生命功能调整、生物制药、新酶和新材料开发等多个关键领域的创新和发展注入了新的活力。该技术的核心是引入外源正交的氨酰-tRNA合成酶/tRNA配对工具,工具的正交性是进行相关技术开发和相应下游应用的基础。在已开发的正交工具配对中,基于吡咯赖氨酰-tRNA合成酶/吡咯赖氨酸tRNA配对(pylRS/tRNApyl)是目前基因密码子拓展技术中最为成熟和广泛使用的工具。开发以pylRS/tRNApyl为代表的相互正交的新型工具是领域中的前沿热点和难点,也是后续开展同时编码多种非天然氨基酸应用的基础。
2022年4月25日,来自深圳华大生命科学研究院团队在Nucleic Acids Research(IF=17)上在线发表题为“The tRNA discriminator base defines the mutual orthogonality of two distinct pyrrolysyl-tRNA synthetase/tRNApyl pairs in the same organism”的研究论文,该研究从嗜盐产甲烷古菌Candidatus Methanohalarchaeum thermophilum HMET1中发掘出2对同时共存的新型的pylRS/tRNApyl配对,利用与HMET1近源的模式嗜盐古菌H. volcanii作为底盘细胞,证明2对pylRS/tRNApyl配对之间具有良好的相互正交性,并进一步揭示tRNApyl2的识别位碱基A73与pylRS2中缩短的motif 2 loop是维持相互正交性的分子基础。基于上述发现,研究最终开发了2对相互正交的非天然氨基酸编码工具,实现在同一种蛋白中同时引入2种不同的非天然氨基酸。
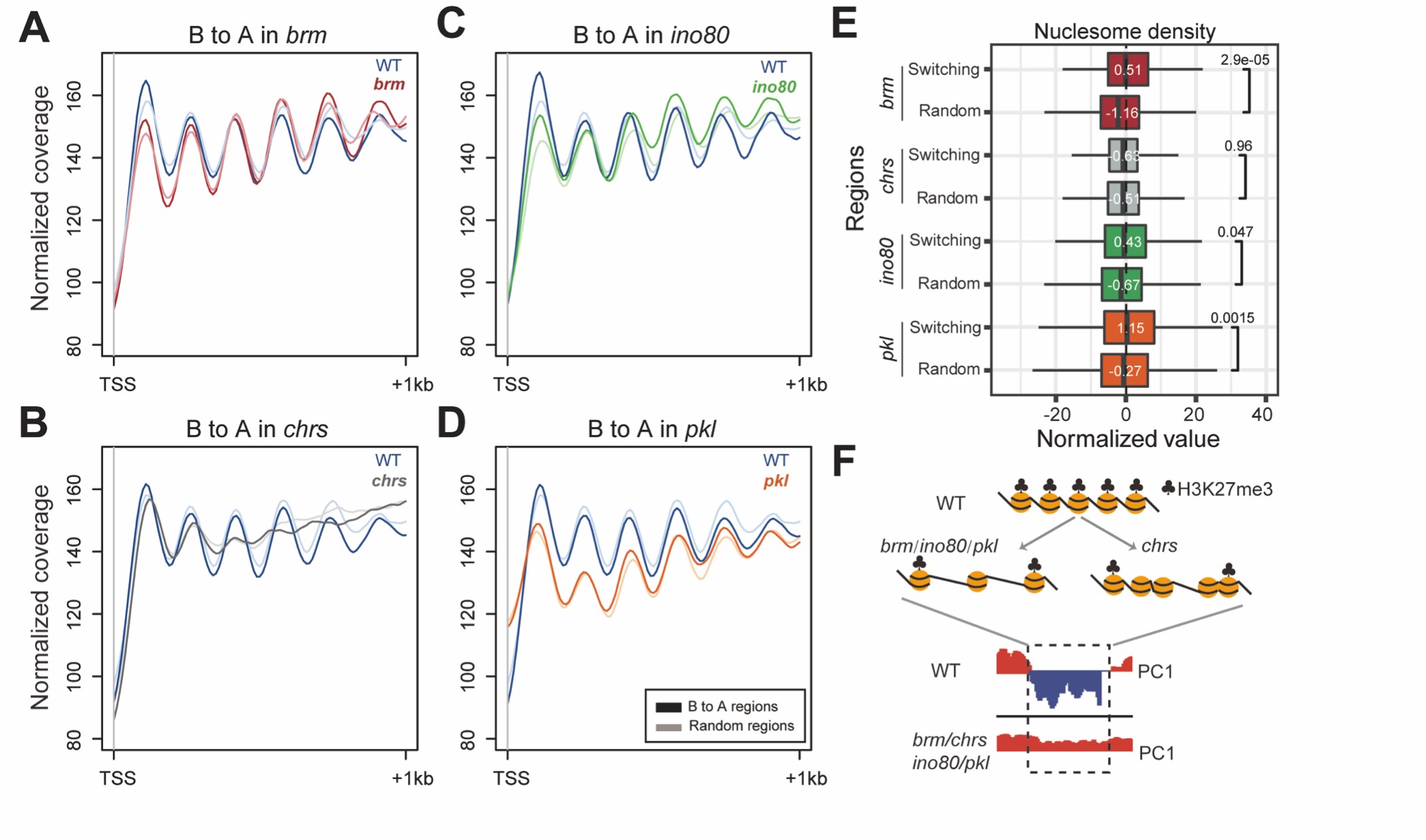
研究首先建立了挖掘pylRS/tRNApyl配对的生信方法,鉴定出古菌中所有只含有催化域的pylRS酶,并在嗜盐产甲烷菌HMET1中发现了同时共存的2对pylRS/tRNApyl配对,是目前发现的唯一共存于同一细胞中的pylRS/tRNApyl配对。研究进一步分析发现2个tRNApyl具有不同的识别位碱基(tRNApyl)。目标pylRS/tRNApyl配对是否具有相互正交性?上述特殊的一级结构与相互正交性有着怎样的关系?
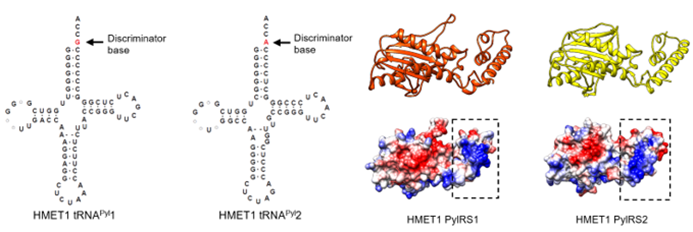
图二. 左) HMET1来源的2个新型tRNApyl的三叶草结构;右) HMET1来源的2个新型pylRS酶的预测结构
由于HMET1来源的pylRS酶在大肠杆菌中不可溶,作者进而选择了模式嗜盐古菌H. volcanii作为底盘细胞来研究目标pylRS/tRNApyl配对的活性,并利用类泛素蛋白SAMp1作为报告蛋白,进而开发了一套在异源底盘中检测pylRS/tRNApyl活性的方法。通过检测由琥珀阻抑介导的非天然氨基酸BocK的引入效率,证明了目标pylRS/tRNApyl均具有体内活性,并通过2对工具之间酶与tRNA的两两互换,进一步证明它们之间具有良好的相互正交性。
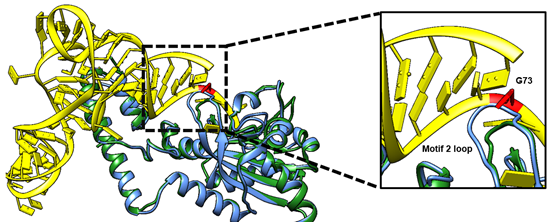
2对目标pylRS/tRNApyl配对之间维持相互正交性的分子基础是怎样的?根据pylRS酶中与tRNApyl互作的结构预测,作者发现2个目标pylRS酶中保守的motif 2 loop(用于识别tRNApyl中的鉴别碱基)拥有不同的长度(图三),通过将pylRS2/tRNApyl2配对中的非典型特征(pylRS2中1个氨基酸截短的motif 2 loop和tRNApyl2中的A73碱基)定向移植到pylRS1/tRNApyl1配对中,揭示了2对目标pylRS/tRNApyl配对之间维持相互正交性的分子机制。此外,通过对pylRS2酶的motif 2 loop进行系统地理性设计改造,发现motif 2 loop的长度而非序列决定了pylRS2氨酰化tRNApyl2的能力。
图三. HMET1来源的2个pylRS酶的motif 2loop与tRNApyl识别互作的结构模拟分析(蓝色为pylRS1酶,绿色为pylRS2酶)
为了进一步证明2对目标pylRS/tRNApyl配对的正交性及后续应用的价值,作者以pylRS1酶为基础构建了可特异性识别非天然氨基酸3-I-phe的pylRS1-SI酶,并构建了可读通TAA终止密码子的tRNApyl2UUA,进而利用pylRS1-SI/tRNApyl1配对与pylRS2/tRNApyl2UUA配对工具实现在报告蛋白SAMp1中的同时引入两种非天然氨基酸BocK和3-I-phe,并通过蛋白免疫印迹和液相色谱与串联质谱证明上述2种非天然氨基酸被分别引入到报告蛋白中TAA与TAG终止密码子指定的位点。总体而言,利用生存环境相似的近源模式生物作为底盘细胞,本研究为探索和研究极端环境下、不可培养微生物中新型的翻译工具提供了独特的研究思路,同时也是首次在古菌中实现基因密码子拓展。本研究阐明了两对新型pylRS/tRNApyl配对特殊的一级结构与它们之间相互正交性的关系,是据我们所知目前最简单的、由单个tRNA碱基和对应的氨酰tRNA合成酶中关键位点共同演化引起身份识别变化的案例,进一步加深了tRNA身份识别机制的理解,因此具有十分重要的理论意义。同时,本研究鉴定出所有只含有催化域的pylRS及其对应的tRNApyl,极大地丰富了非天然氨基酸编码工具库,开发出可同时基因编码2种非标准氨基酸的pylRS/tRNApyl工具,并为基于嗜盐蛋白的工程改造提供了新策略,因此在合成生物学领域也具有重要的实际应用价值。
来自深圳华大生命科学研究院的付宪副研究员与沈玥研究员、耶鲁大学Dieter Söll教授为该论文的共同通讯作者。来自深圳华大生命科学研究院的张浩霖、中国科学院大学生命科学学院(华大专项)的龚雪梅(博士二年级)、赵倩倩(已毕业)为该论文的共同第一作者。美国国立卫生研究院 Eugene Koonin 团队、美国佛罗里达大学的JulieMaupin-Furlow教授、日本立教大学的Mukai Takahito助理教授对于该研究提供了重要帮助。