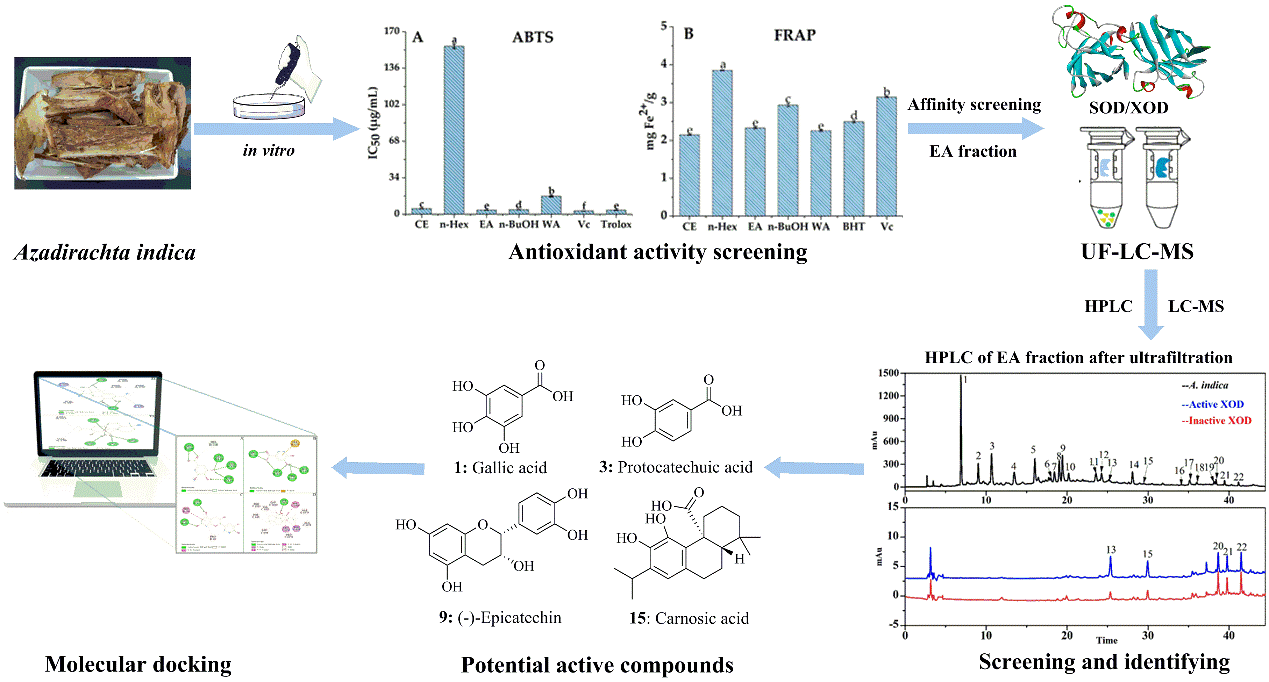
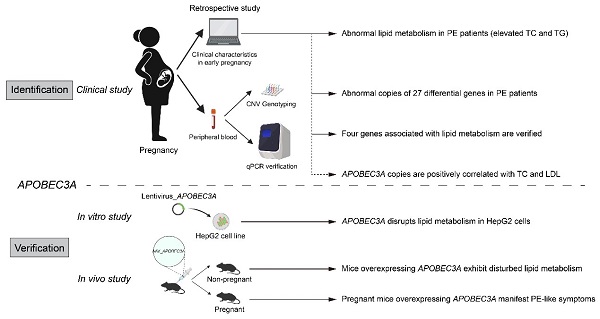
我院孙涛、蒋晨课题组在克服基质屏障治疗胰腺癌方面取得进展

图1,本项工作发表于Wiley出版社Small杂志,并被选为当期封面(FrontCover)。图示巧妙利用冰壶比赛中的“一石二鸟”策略来描述本项工作设计理念——通过逆转免疫抑制和解除耐药实现胰腺癌有效治疗,同时向刚结束的北京冬奥会致敬。
随着全球发病率的提升,胰腺癌(pDAC)显示出最差的预后,5年生存率低于5%。尽管相关研究不断开展,但是由于pDAC以间质的结缔组织增生为显著特征,提高了肿瘤内压力,产生了较大的耐药性。吉西他滨,作为针对pDAC的一线化疗药物,通常与针对基质的药物或疗法联合使用,然而这些疗法的效果也存在一些缺陷。因为这些疗法造成基质溶解会加速肿瘤细胞的扩散和转移,所以最佳的方法应该是在维持pDAC外层基质的前提下,促进化疗药物的深层渗透,以规避治疗过程中转移。
pDAC中另一个棘手的难题是免疫抑制微环境,胰腺肿瘤微环境的大多数免疫细胞被肿瘤劫持,导致免疫抑制,甚至支持肿瘤进展。而骨髓源性抑制细胞(MDSCs)在介导肿瘤细胞的免疫逃逸中发挥关键作用。
近期,药剂学系孙涛副教授等开发了一种利用电荷翻转,实现克服胰腺癌致密基质,再教育肿瘤免疫抑制微环境的纳米递药系统。相关成果以《逆转胰腺癌免疫抑制微环境和改善耐药性的基质穿透胶束》(penetrating Micelle for Reversing Immunosuppression and Drug Resistance in pancreatic Cancer Treatment)为题,发表在国际期刊Small上,并被遴选为当期封面(FrontCover)。
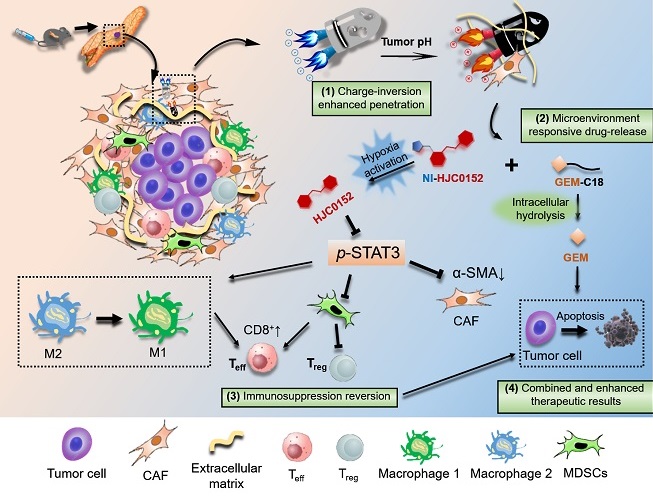
图2,本项工作设计的电荷反转式递药系统,可响应于肿瘤微酸微环境实现电荷由负变正的反转,实现深部穿透和药物递送;并在胰腺癌乏氧微环境下实现前药激活,用于抑制STAT3靶点,以协同与共负载的吉西他滨药物,最终同时达到逆转免疫抑制和解除耐药的目的。
该研究针对胰腺癌的病理特点,开发了一种多功能药物递送系统,联合脂质修饰的吉西他滨与STAT3抑制剂HJC0152,克服了以上困难,成功实现了药物深层次递送。具体而言,通过构建肿瘤酸性微环境响应的两亲性嵌段材料实现在肿瘤部位电荷翻转,嵌段材料通过形成胶束,包载两种药物:疏水性吉西他滨可以改善肿瘤细胞的耐药性,提高药物毒性;乏氧响应的药物HJC0152,特异性针对STAT3靶点,对整个肿瘤微环境起到再教育的作用。
药学院博士生陈钦俊、汪瑜与瑞金医院临床医生王庆兵博士并列为论文的第一作者,孙涛副教授、蒋晨教授为论文的通讯作者。该研究获得国家自然科学基金重大研究计划培育项目及重点项目的资助。
DOI: https://onlinelibrary.wiley.com/doi/10.1002/smll.202107712