武汉病毒所/生物安全大科学中心解析鄂木斯克出血热病毒加帽过程共价中间体结构
2022-07-26 10:26:39
来源:网络整理
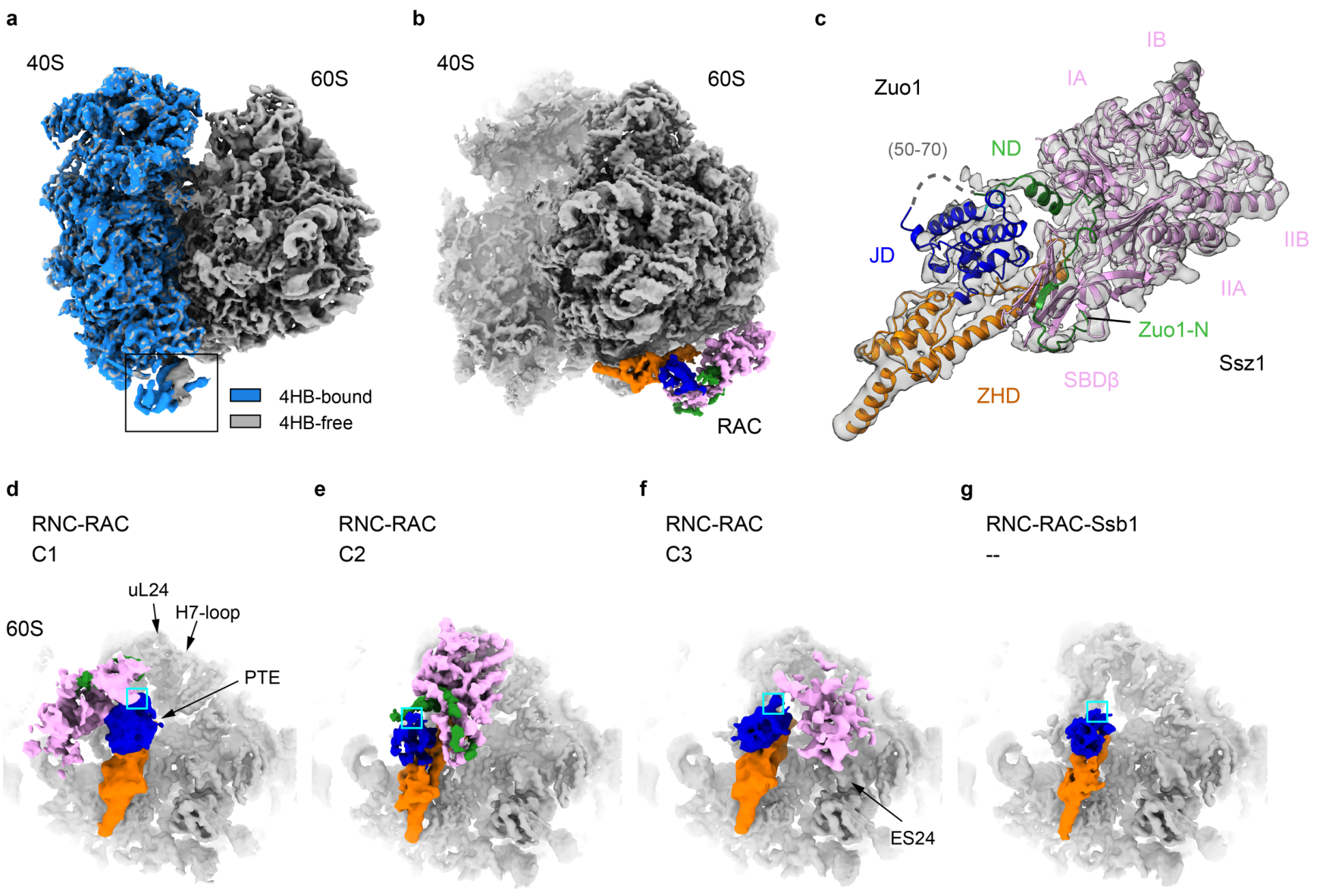
在真核细胞中,信使RNA加帽现象较为普遍,帽子结构对维持RNA的稳定性以及促进蛋白质翻译至关重要。一些RNA病毒的基因组也具有帽子结构,由于多数RNA病毒在细胞质中复制,而宿主的加帽体系存在于细胞核中,因此某些病毒需要编码加帽酶,拥有自身的加帽体系。如登革病毒、乙型脑炎病毒等黄病毒编码的NS3和NS5蛋白都参与病毒基因组的加帽过程(图1A)。与宿主加帽过程类似,黄病毒加帽涉及鸟苷酰转移反应,该反应可将鸟苷三磷酸(GTp)中的鸟苷单磷酸(GMp)模块连接到RNA的5"-端。研究表明该反应过程中可形成GMp-蛋白质共价中间体,即GMp先与特定的氨基酸残基的侧链形成共价键,进而被转移到RNA末端形成GpppRNA。在黄病毒相关研究中,有证据显示NS5可与GMp形成共价中间体,但具体的氨基酸残基未能得到确证。中国科学院武汉病毒研究所龚鹏研究员团队长期从事RNA病毒聚合酶的催化与调控机制研究,黄病毒NS5蛋白是加帽酶和聚合酶的融合蛋白,其N端结构域兼具甲基转移酶(methyltransferase,MTase)和鸟苷酰转移酶(guanylyltransferase,GTase)功能。近期该团队解析了蜱传黄病毒鄂木斯克出血热病毒(Omsk hemorrhagic fever virus,OHFV)NS5加帽酶的系列高分辨率晶体结构(图1B,分辨率1.4-2.1埃),成功捕获了GMp和m7GMp(鸟苷N7位甲基化的GMp)与NS5第28位精氨酸(Arg28)形成的共价中间体(图1C;图1D下方结构)。部分黄病毒NS5该位点为赖氨酸(Lys),提示GMp-Arg和GMp-Lys共价中间体均可能存在(图1C),而m7GMp-Arg结构则提示帽子鸟苷N7甲基化也有可能发生在鸟苷酰转移反应之前,这些结构证据为深入理解黄病毒加帽机制提供了重要参考。此外,单磷酸核苷和精氨酸形成的共价分子此前在转移酶和连接酶中均未被观测到。与其他氨基酸相比,精氨酸形成的这类共价分子有何独特之处,共价分子的形成过程及后续反应的特征等均尚待进一步研究。相关论文近期在线发表于Journal of Virology上,此项研究受到科技部、国家自然科学基金委员会、中国科学院武汉国家生物安全实验室、湖北江夏实验室等的经费支持。武汉病毒所博士生荚恒霞为论文第一作者,武汉病毒所硕士生钟尧和中国科学院蛋白质科学研究中心彭超研究员为共同作者,龚鹏研究员为通讯作者。
论文链接为:https://journals.asm.org/doi/10.1128/jvi.00418-22

图1.黄病毒加帽过程中可形成GMp-精氨酸共价中间体。A)黄病毒RNA的加帽过程示意图。B) OHFV NS5 N端结构域的晶体结构。C)基于结构的12种黄病毒GTp/帽子相互作用模块的部分序列比对。D) GTp/GMp-Arg28共价中间体和m7GTp/m7GMp-Arg28共价中间体结构。其中GTp/GMp、m7GTp/ m7GMp、Arg28的2Fo-Fc电子密度(经3500 K拼合模拟退火处理,0.8σ水平)同时显示。