氨基酸缺乏可缩小儿童期肿瘤
每年,大约每10万名儿童中就有一人罹患新的神经母细胞瘤,通常发生在出生后的第一年。这使得神经母细胞瘤成为儿童中相对常见的一组肿瘤。它们在胚胎发育期间在未成熟的神经组织中形成,主要发生在肾上腺、脊柱、颈部、胸部、腹部和骨盆。神经母细胞瘤很难治疗,通常对治疗有耐药性。婴儿和幼儿尤其受影响。在某些情况下,肿瘤在没有任何治疗的情况下完全消退。然而,在大约一半的患者中,尽管进行了高度密集的治疗,但病情仍在不断恶化。
一个决定疾病发展方向的重要调控因子是癌症基因MYCN。直到最近人们才知道,这种癌症基因决定了前体细胞是发展成成熟的神经细胞还是发展成恶性的神经母细胞瘤细胞。进展不利的神经母细胞瘤在其基因组中也携带数百个MYCN基因的活跃拷贝。MYCN的高活性导致癌细胞的新陈代谢发生深刻的变化,因为MYCN反过来开启和关闭大量其他基因。但是这给癌细胞带来了什么好处呢?这个高度专门化的网络能被特别地破坏来积极地对抗癌细胞吗?
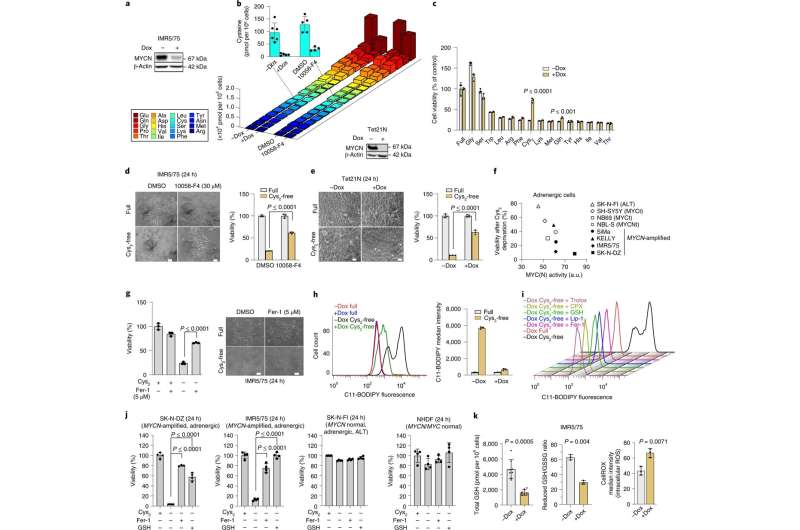
这些是由海德堡Hopp儿童癌症中心(KiTZ)和德国癌症研究中心(DKFZ)的Frank Westermann、Andreas Trumpp、DKFZ和HI-STEM gGmbH以及DKFZ的Thomas H?fer领导的科学家团队提出的问题。在目前的研究中,第一作者Hamed alborziniia和Andres Florez发现具有高MYCN活性的神经母细胞瘤细胞需要一种特别的东西:氨基酸半胱氨酸。半胱氨酸是大多数细胞蛋白质和脂类的重要组成部分。快速增长的癌细胞需要大量的这些物质来产生新的细胞。
与此同时,癌细胞需要半胱氨酸来保护自己免受自然发生的有毒过氧化物的伤害,过氧化物是由癌细胞高度活跃的新陈代谢有条件地产生的。“神经母细胞瘤细胞对半胱氨酸的需求是如此之大,以至于它们使用两种途径来获取半胱氨酸,”该研究的另一位第一作者西娜·克雷斯(Sina Kreth)说。第一作者Lena Brückner补充说:“他们利用氨基酸的进口,另外开辟了一条替代合成途径,从蛋氨酸中获得半胱氨酸。”
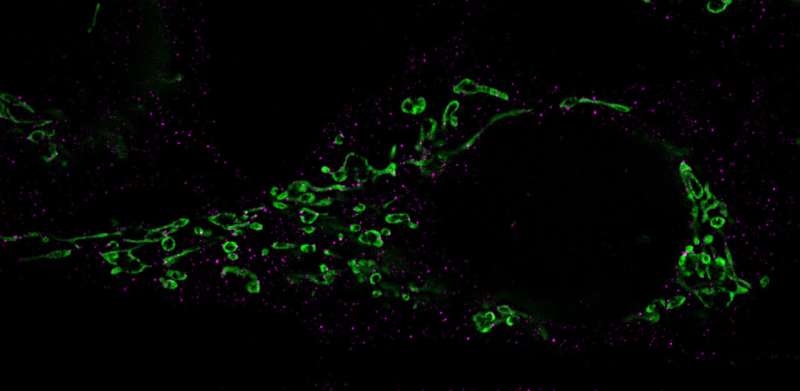
然而,正是这些适应过程使神经母细胞瘤细胞变得敏感。如果科学家剥夺了它们的半胱氨酸,mycn驱动的肿瘤细胞就不能再灭活产生的有毒过氧化物,并因ferroptosis(一种细胞死亡的特殊形式)而死亡。研究小组随后测试了这一过程是否可能成为治疗小鼠恶性神经母细胞瘤的潜在致命弱点。
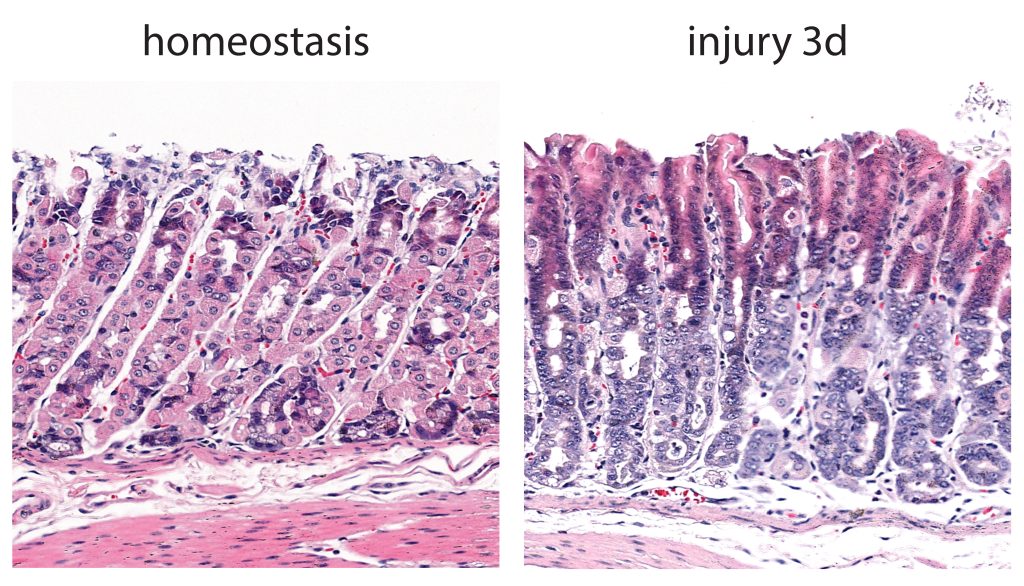
科学家们故意关闭了通往肿瘤的水龙头:他们阻止了半胱氨酸的摄取、半胱氨酸的合成,还关闭了一种关键酶,这种酶通常可以防止癌细胞用过氧化物毒害自己。然后癌细胞通过ferroptosis开始自我毁灭,肿瘤缩小。
Hamed Alborzinia强调说:“Ferroptosis细胞死亡在几年前才被发现,现在的结果第一次显示,不仅在细胞培养中,而且在携带癌症的老鼠中,这个过程可以被控制,通过诱导Ferroptosis杀死具有高度侵略性的人类神经母细胞瘤细胞。”
这一发现也为为什么婴儿和幼儿中MYCN中度活性的神经母细胞瘤在某些情况下消失提供了可能的解释:“细胞在生命的最初几年基本上占据较少的半胱氨酸。因此,当它们开始不受控制地分裂时,它们很快就会耗尽半胱氨酸储备,从而引发细胞死亡,”安德烈斯·弗洛雷斯解释道。一些没有MYCN活性的神经母细胞瘤无法逃脱这种自我毁灭,然后在半胱氨酸变得稀少的一段时间后死亡。
对于MYCN活性高的高危患者,该研究首次提供了关于半胱氨酸摄取、生产和消耗之间的平衡如何可能被扰乱,从而这些细胞也开始自我毁灭的洞见。新发现的原理是否也能证明对神经母细胞瘤患者的治疗有效,现在必须进行临床试验。
这项研究发表在《自然癌症》杂志上。