《免疫》肠道微生物通过cGAS-STING-IFN-I轴启动免疫系统抗病毒
人体的微生物群对健康至关重要,但这些非侵入性微生物是如何与身体其他部位进行交流,从而影响宿主生理机能的,目前还不完全清楚。来自斯德哥尔摩Ume?和哥德堡大学的研究人员现在报告了对小鼠的研究,表明肠道微生物群对支持对病毒感染的自然抵抗至关重要。他们的研究表明,从肠道微生物释放膜囊泡导致细菌DNA的系统性传递到宿主细胞,然后触发细胞质cGAS-STING-IFN-I通路进行先天免疫DNA感应,以保护远端器官免受病毒感染。
由斯德哥尔摩大学的Nelson Gekara博士领导的研究小组在《免疫》杂志上报告了他们的研究结果,指出这项研究还揭示了“在病毒感染期间使用抗生素的风险未得到充分认识”。正如Gekara指出的,“在当前全球病毒大流行的时代,一个相关的、或许是及时的信息是,过度使用抗生素会加剧病毒感染。”研究人员发表的论文题为“肠道微生物通过cGAS-STING-IFN-I轴启动系统抗病毒免疫。”

作者解释说,所有多细胞生物的表面都居住着共生微生物——统称为微生物——它们影响许多宿主的生理过程。绝大多数微生物群是居住在肠道内的细胞外细菌。这些微生物对免疫系统的发育和成熟至关重要,它们还通过与细菌和真菌病原体竞争营养物或附着位点,并通过产生抗菌物质来抵御细菌和真菌病原体。但是,肠道内的微生物如何介导系统免疫调节,以及它们对病毒感染的影响,尚不完全清楚。该团队继续说:“尽管众所周知,微生物群在屏障位置对细菌和真菌病原体提供了竞争性阻碍,但微生物群如何影响病毒感染仍存在争议。”“根据不同的环境,它们可以促进或防止病毒入侵。”
I型干扰素(IFN-Is)对抗病毒免疫至关重要,在过去的几十年里,“……越来越多的文献表明微生物群在IFN-I启动中发挥了作用,”研究人员继续说。然而,了解微生物群如何启动IFN-I系统的努力得出了“相互矛盾的结论”。此外,“这些专性细胞外微生物如何在宿主屏障表面与远端免疫细胞沟通,从而介导全身免疫调节,目前仍未解决。
在他们最新报道的工作中,该团队调查了肠道共生细菌可能如何调节系统免疫和对病毒感染的反应。Ume?大学的第一作者Saskia Erttmann博士说:“我们对肠道细菌对病毒感染的影响感兴趣。因此,我们用抗生素治疗小鼠,然后用两种不同类型的病毒感染它们——DNA病毒,1型单纯疱疹病毒(HSV-1),或RNA病毒,水泡性口炎病毒(VSV)。我们发现,抗生素治疗使小鼠对这些病毒更敏感,这是由于称为I型干扰素(IFN-Is)的抗病毒免疫分子的基本表达减少。”
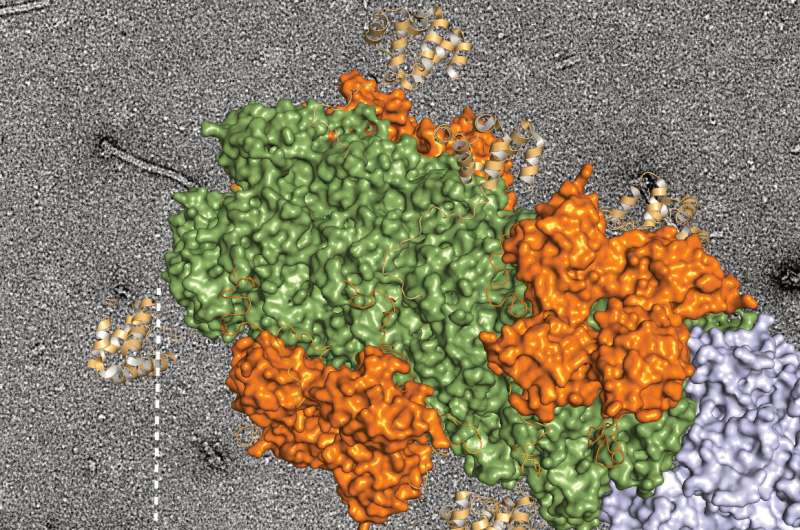
免疫系统通过几个先天受体家族检测微生物。这些包括观察细胞外环境的细胞表面定位toll样受体(TLRs),以及像环GMp-AMp合酶(cGAS)这样的细胞质受体,它们在细胞内出现外来或错位的DNA时向免疫系统发出警报。cGAS感应DNA,合成环GMp-AMp (cGAMp), cGAMp通过干扰素基因刺激器(STING)发出信号,诱导IFN-Is的表达。
为了了解微生物如何诱导IFN-Is的基础表达,作者分析了不同先天免疫通路缺陷的小鼠。他们发现,微生物群对IFN-Is的诱导涉及到cGAS-STING通路的强直性激活,而这并不需要细菌与宿主细胞的直接接触。他们写道:“微生物驱动的强直ifn - i反应依赖于cGAS-STING,而不是TLR信号或宿主与细菌的直接相互作用。”“通过分析几只敲除小鼠,我们的结果显示,在体内的TLRs对IFN-I启动有少量或多余的贡献。”相比之下,cgas - sting通路消融的小鼠对HSV-1和VSV感染的反应较弱,且更容易受到感染。
细胞外微生物(包括肠道微生物群)的固有免疫感知通常被认为是通过细胞表面受体(如TLRs)发生的,而胞质免疫受体(如cGAS)的激活只发生在对侵入性DNA病毒、致病菌、或者寄生虫携带致病因子,允许它们入侵细胞并在细胞内复制,”Gekara说。
因此,发现细胞内cGAS-STING通路是细胞外肠道细菌的传感器是出乎意料的。此外,我们还不清楚肠道细菌是如何通过黏液和肠道上皮层等屏障从宿主细胞中分离出来的,尽管如此,它们仍然能够触发系统的cGAS-STING-IFN-I反应,以保护远端器官免受病毒侵害。”
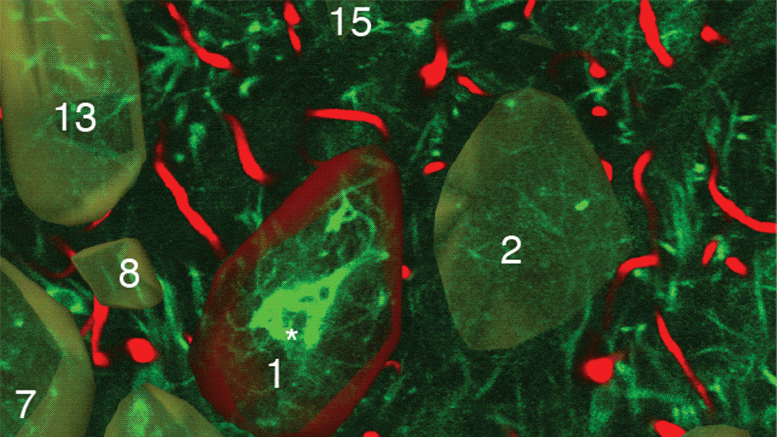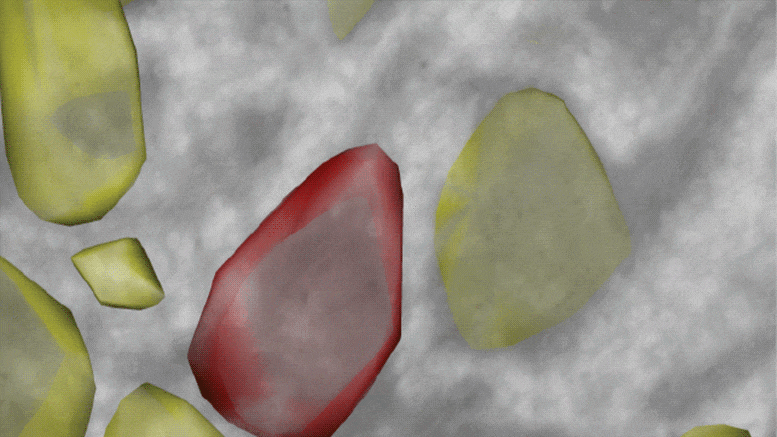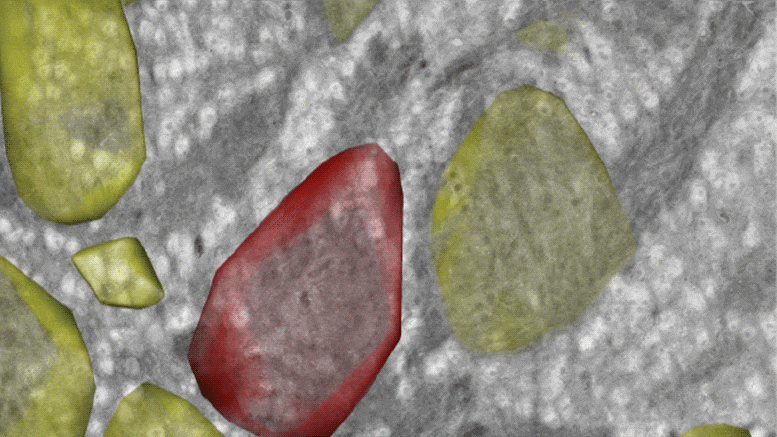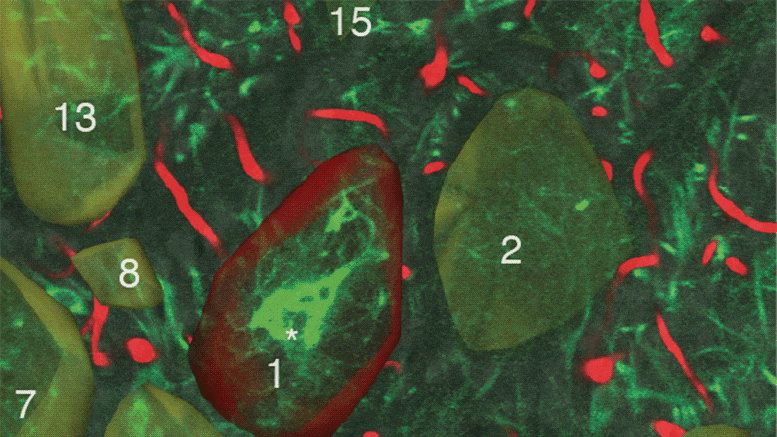
细菌膜泡(mv)是由细菌释放的脂质双分子层小泡,可能穿过组织和细胞膜屏障。Gekara和他的同事认为mv是一种可能的载体,可以让肠道细菌将DNA传递到远处的宿主细胞,从而介导cGAS-STING-IFN-I系统反应。他们的研究随后证实,血液循环中存在来自肠道菌群的含dna膜泡,当与细胞在体外培养或接种到小鼠体内时,这种mv促进了病毒的清除。“来自细胞外细菌的膜囊泡(mov)通过将细菌DNA传递到远端宿主细胞激活cGAS-STING-IFN-I轴,”该团队指出。从肠道微生物中发现含有DNA的mv在循环中,并以cgas依赖的方式促进DNA(1型单纯疱疹病毒)和RNA(水泡性口炎病毒)的清除。
Gekara说:“这项研究填补了我们对肠道菌群如何介导系统免疫调节的理解的一个重要空白。”他补充说,研究结果还“强调了抗生素的风险被低估”。自我用药的病人通常使用抗生素来“治疗”未确诊的疾病,有时也会开给病人抗生素,作为预防病毒感染后出现的细菌感染的一种措施。“我们的研究结果表明,通过扰乱微生物群,抗生素可以不利地削弱我们抵抗病毒感染的能力。”
作者进一步总结道:“这些发现强调了微生物群在维持免疫系统对病毒的持续防备状态中的重要性,并强调了在病毒感染期间不正当使用抗生素的风险被低估。”