研究表观遗传药物的新工具
化学蛋白质组学组长,Guillaume Médard博士和他的实验室研究小组。一个国际研究小组现在更详细地研究了一些HDAC药物的作用。科学家们研究了epi-drugs是否会影响HDACs以外的蛋白质,而HDACs正是它们被设计用来抑制的。
组蛋白去乙酰化酶(HDAC)抑制剂是一类用于肿瘤治疗的药物。
一个由慕尼黑工业大学(TUM)、美国伊萨卡康奈尔大学(Cornell University in Ithaca)、海德堡德国癌症研究中心(DKFZ)和哈雷威滕堡马丁路德大学(Martin Luther University of Halle-Wittenberg)的科学家组成的国际研究小组现在更详细地研究了一些HDAC药物的影响。科学家们研究了epi-drugs是否会影响HDACs以外的蛋白质,当初它们被设计用来抑制HDACs。
由于大多数蛋白质的功能依赖于小分子配体与蛋白质的结合,因此,利用能与靶蛋白特异作用的化学小分子来扰动、探测蛋白质组,便有可能在蛋白质组整体水平上揭示目标蛋白的功能以及它们与化学小分子的相互作用。
要做到这一点,化学蛋白质组学的目标反褶积是首选的方法。
科学家首先制造了新的化学工具——所谓的亲和矩阵——这将使我们能够系统地分析HDACs,Guillaume Médard博士解释说,在Bernhard Küster教授领导下,Médard博士是化学蛋白质组学小组带头人。
化学蛋白质组学分析HDAC药物
慕尼黑大学生命科学学院的博士生Severin Lechner说:“我分析了53种药物,其中大多数,但不是所有,都达到了预期的HDAC目标。然而,也有一些意外。在数百项科学研究中使用的药物并不像人们所认为的那样具有选择性。其中许多还有以前不为人知的额外目标。”
这些结果凸显了蛋白质组学方法的力量,因为它们可以同时探测到数千个蛋白质的结合。最后,该团队确定了几种具有杰出选择性的分子,使它们成为未来科学研究的首选抑制剂。
HDAC药物的靶区
Lechner继续说道:“最意想不到的发现是,MBLAC2对一半的被分析分子都脱靶了。”这种蛋白质的特征还不清楚。巧合的是,康奈尔大学的Maurine Linder教授团队也在同一时间进行了研究。两组研究人员进行了合作,证实了这种蛋白质在药物的作用下确实受到了阻碍。
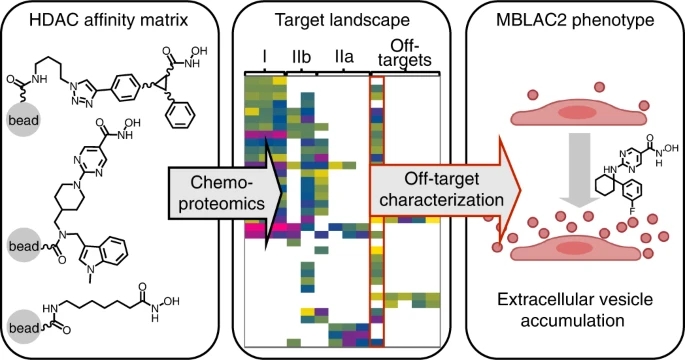
Lechner与TUM的Michael pfaffl教授的团队合作,研究了一些药物暗示的无法解释的表型效应,并证明MBLAC2抑制或敲除导致细胞外空间的胞外囊泡积累。细胞外囊泡是由细胞分泌的具有膜结合的小颗粒,通过全身运输,在细胞和组织之间传递生物分子和信息。
基础研究,预示着未来
“我们很兴奋,因为我们在生物学领域发现了一个新的玩家,明显包括外泌体,在神经学,免疫学和肿瘤学中发挥关键作用,”解释Médard。“我们现在正在设计只撞击MBLAC2的分子,这样我们就可以在一系列模型系统中探测这种模糊的蛋白质。”
这项研究将有助于那些希望将HDAC抑制剂用于探测生物学或治疗用途的人。它有助于选择正确的化学工具。对于药物化学家来说,这也是一组有价值的数据,他们需要了解化学结构与药效和选择性之间的关系,以便制造未来的epi-drugs。
Target deconvolution of HDAC pharmacopoeia reveals MBLAC2 as common off-target