一种很有前途的抗癌分子
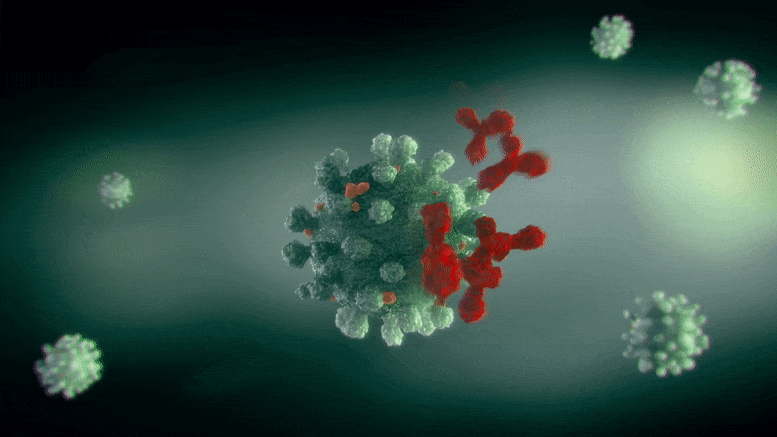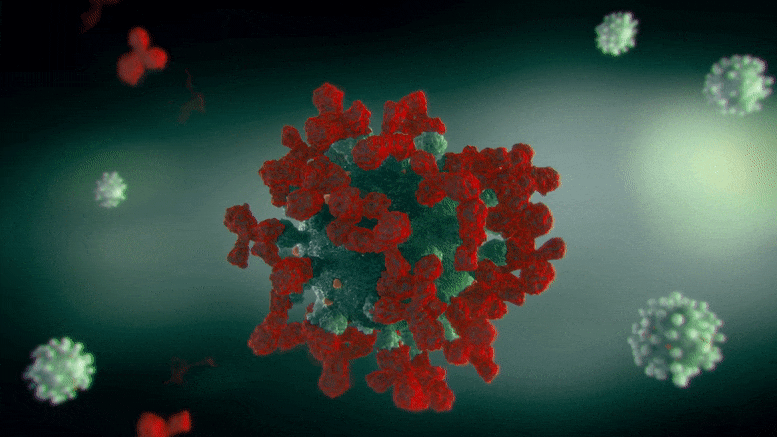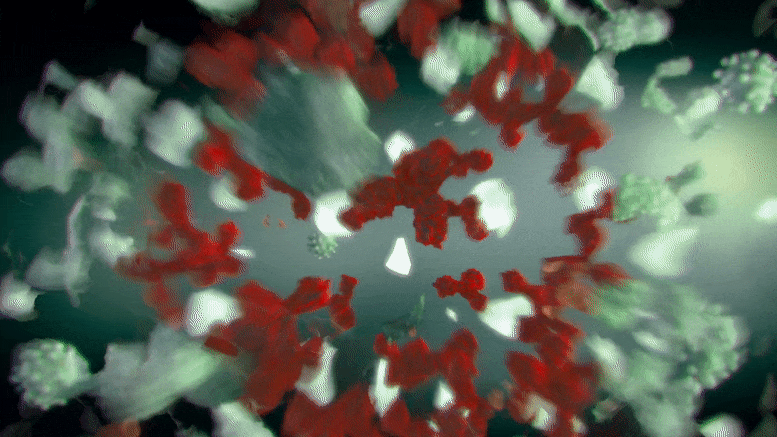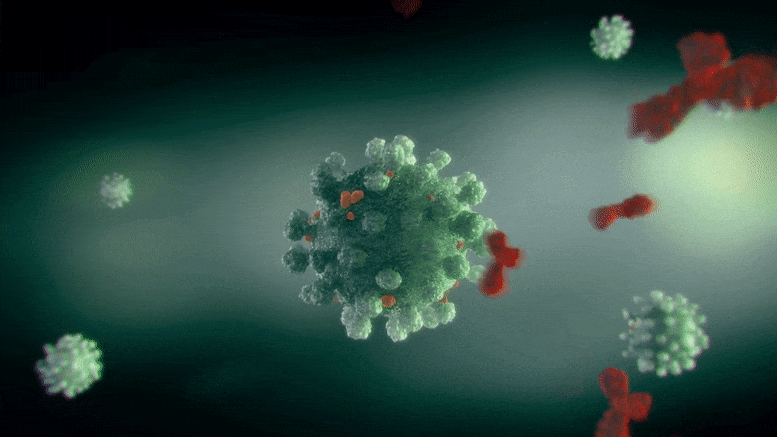
这种分子背后的生物分子机制是抑制在各种形式的癌症中过度产生的一种酶
维生素D3执行重要的生物任务,如维持骨密度,从而降低骨折的风险。然而,维生素D3被认为具有抗癌作用,因为维生素D3水平低以及随之而来的CYp24酶的过量产生与癌症患者的不良预后有关。限制或抑制CYp24活性的分子,以及模仿维生素D3作用的分子,现在正被研究作为治疗癌症的抗增殖药物。然而,到目前为止,许多开发的抑制剂和D3类似物的临床反应不足,以及不良的副作用。金泽大学的Madhu Biyani和他的同事们发现了一种来自DNA的化学物质,它可以结合并抑制CYp24的作用,同时也显示出很有希望的抗增殖活性。此外,该研究团队还对潜在的分子机制提供了广泛的见解。
HS-AFM与分子对接结合揭示Apt-7与CYp24的结合机制(A) CYp24与Apt-7的顶级对接构像的三维视图。箭头显示Apt-7的预测结合位点。适配体分别与CYp24的底物结合位点(结合位点-1)和CYp24的ADX结合位点(结合位点-2)结合。(B)通过分子对接生成CYp24-Apt-7复合物的顶级位姿得到的CYp24-Apt-7伪HS-AFM图形与HS-AFM实时图像的比较。
研究人员测试了大量的DNA适配体,这是一种具有特殊三维结构的单链DNA片段,可以与特定的目标分子结合,并在结合时产生功能性作用。他们寻找能与CYp24结合,但不能与负责合成维生素D3的类似酶CYp271B结合的DNA适配体。
最初的18个适体候选基因被缩小到11个具有特定分子结构的候选基因。对11个具有代表性的适配体进行了体外抑制CYp24的能力测试。保留了4个抑制CYp24而不抑制CYp27B1的候选基因,其中一个(Apt-7)留作进一步研究
Biyani和同事模拟了Apt-7与CYp24的结合。他们获得了一个分子对接方案,通过比较维生素D3和CYp24的混合物加入和不加入Apt-7的行为进行实验验证。模拟和实验表明,Apt-7抑制了CYp24的活性,发生的情况是适体可能干扰了酶的活性位点。研究人员还对CYp24和Apt-7的结合进行了实时的高速原子力显微镜观察,证实了模拟得到的分子对接场景。
最后,研究小组通过将Apt-7分子引入癌细胞,研究了其在细胞水平上的作用。他们观察到对一种过表达CYp24酶的癌细胞有显著的CYp24抑制作用,从而显示出抗增殖活性。引用Biyani和同事的话,这些发现“清楚地描述并提出了一种基于DNA适体的分子可能是一种有希望的抗癌治疗的领先候选人。”
参考文献:“Novel DNA Aptamer for CYp24A1 Inhibition with Enhanced Antiproliferative Activity in Cancer Cells” by Madhu Biyani, Kaori Yasuda, Yasuhiro Isogai, Yuki Okamoto, Wei Weilin, Noriyuki Kodera, Holger Flechsig, Toshiyuki Sakaki, Miki Nakajima and Manish Biyani, 18 April 2022, ACS Applied Materials & Interfaces.
DOI: 10.1021/acsami.1c22965









