南京大学生命科学学院张峻峰、董磊团队在肝脏组织再生领域取得重要进展
2022年1月7日,南京大学生命科学学院、医药生物技术国家重点实验室董磊教授、张峻峰教授和澳门大学王春明教授团队在国际期刊Gut上在线发表了题为“Reprogramming the Spleen into a Functioning Liver in vivo”的原创研究论文[1]。该研究采用材料诱导组织重构和直接重编程技术将脾脏成纤维细胞原位重编程为肝细胞,无需引入外源的肝细胞或组织,实现脾脏向肝脏的功能转化。
全世界每年约有200多万人死于肝病。原位肝移植是治疗终末期肝疾病最有效的手段。但是,肝供体器官和细胞严重短缺是一项全球性的医学难题。寻求肝移植的替代手段至关重要。组织工程已经构建出有功能的结构简单的组织或器官。然而,现有的组织工程技术无法重建肝脏发挥功能所需的丰富的血管网络。相比于“工程化”地建立结构复杂的肝组织器官,器官的“转化”是一个新的思路:将体内现有的、不需要的、血管丰富的器官(脾脏)转化为一个更重要的器官(肝脏)。
在2020年6月,该研究团队发表Science Advances上的研究已经实现将小鼠脾脏改造为具有肝脏功能的器官[2],通过对脾脏注射活性生物试剂,重塑脾脏微环境,增加基质含量,降低免疫排斥反应,同时使血管更加丰富。其次,再移植不同种系来源的肝细胞。移植的肝细胞可以在改造脾脏内很好地生长增殖,并发挥肝脏的重要功能。Science Advances上的研究是将肝细胞移植到脾脏,解决了再生肝脏长大、整合和功能化问题,但尚未解决免疫排斥和种子细胞来源这些组织再生的固有问题。而发表在Gut的这项最新研究,则是采用了重编程技术,在体内将自体脾脏成纤维细胞直接变成肝细胞,理论上就消除了免疫排斥和细胞供体等问题,是真正意义上让脾脏长出自己的肝组织。
在该项最新研究中,研究团队首先将脾脏从腹腔移位到皮下,方便对脾脏的连续注射和观察,再对脾脏注射二氧化硅(SiO2)纳米颗粒,促进脾脏内成纤维细胞的增殖,为后续的重编程和肝再生奠定基础。接下来,研究团队使用慢病毒作为递送载体,让脾脏细胞过表达肝脏特异性的转录因子(Foxa3、Gata4和Hnf1a),使脾脏成纤维细胞原位转分化为有功能的肝细胞。最后,通过对脾脏输送肿瘤坏死因子-α(TNF-α)蛋白和过表达表皮生长因子(EGF)和肝细胞生长因子(HGF)的慢病毒,进一步促进脾内转分化肝细胞的增殖。转化后的脾脏内肝细胞的数量达到了8×106个,而且能够稳定存在长达6个月的时间,并具有典型的肝脏生理功能(图1)。
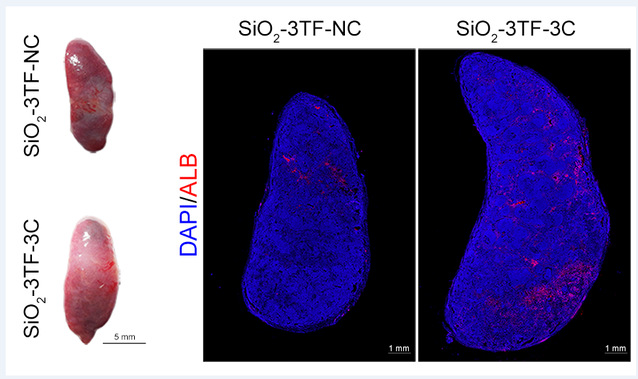
图1转化脾内存在大量的肝细胞
为重要地是,在90%肝切除诱导的急性肝衰竭实验中,成功构建转化脾的小鼠存活率为50%,而未改造的小鼠全部死亡,说明转化脾能够代偿肝脏发挥功能(图2)。
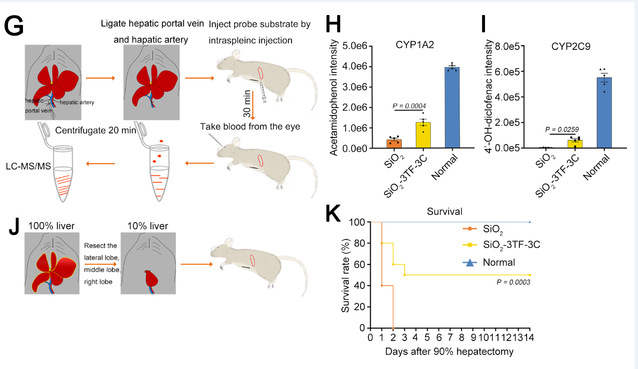
图2转化脾具有肝脏的生理功能
该项研究不同于现有的全器官移植、组织工程或细胞移植等肝再生手段,无需引入外源的肝细胞或组织,成功地在体内构建了有功能的大型肝组织,避免了细胞移植面临的供体细胞短缺和免疫排斥的问题,为大型组织的功能性重建和终末期肝疾病治理提供了全新的解决策略。
南京大学董磊教授、张峻峰教授和澳门大学王春明教授是本文的通讯作者。南京大学生命科学学院刘春艳博士和澳门大学濠江学者王琳涛博士为文章的共同第一作者。这一系列研究得到国家自然科学基金和澳门科学技术发展基金联合科研项目(内地方:董磊,澳门方:王春明)的资助。
文章链接:
1. https://gut.bmj.com/content/early/2022/01/06/gutjnl-2021-325018
2.https://doi.org/10.1126/sciadv.aaz9974






























