肖能明课题组在Science Advances发文揭示线粒体代谢促进效应CD8+...
细胞毒性T淋巴细胞(CTLs)是清除病原体和肿瘤的重要免疫细胞。机体受到感染后,CD8+T细胞会分化形成短寿命效应细胞(SLECs; KLRG1+CD127-)或者记忆前体效应细胞(MpECs; KLRG1-CD127+)。静息状态的初始CD8+T细胞依赖于线粒体氧化磷酸化来维持细胞的存活,当T细胞活化后,CD8+T细胞会升高氧化磷酸化和糖酵解水平,以此满足生物合成和能量需求。尽管效应CD8+T细胞能利用糖酵解来支撑其增殖和效应功能,但是短暂升高的线粒体氧化磷酸化对效应细胞的分化有什么作用,目前还知之甚少。
2021年12月3日,厦门大学生命科学学院/细胞应激生物学国家重点实验室肖能明教授课题组,在Science Advances杂志上发表了题为“Mitochondrial C1qbp promotes differentiation of effector CD8+T cells via metabolic-epigenetic reprogramming”的研究论文,揭示了线粒体C1qbp在效应CD8+T细胞分化中的重要调控作用及其分子机制,为线粒体代谢和效应CD8+T细胞分化提供了机制上的联系。

C1qbp(补体C1q结合蛋白,又称为p32或gC1qR)是一种已知的对线粒体氧化磷酸化很重要的多功能蛋白,能通过结合RNA的方式促进线粒体基因编码蛋白的翻译。而C1qbp在T细胞中发挥何种作用,目前还缺少相关研究。
研究人员发现C1qbp在T细胞活化后能被短暂诱导表达;在LCMV病毒急性感染实验模型和B16F10黑色素瘤模型中,相较于野生型(WT)小鼠,T细胞特异性C1qbp敲除(C1qbpfl/fldLckCre)小鼠体内CD8+T细胞无法正常分化成短寿命效应T细胞,同时分泌效应细胞因子的能力也明显下降。活化的C1qbp缺失CD8+T细胞中线粒体形态发生显著变化,线粒体基因编码的呼吸链亚基蛋白质合成受到抑制,本应迅速增强的氧化磷酸化和线粒体膜电势等线粒体功能受损,代谢通路发生紊乱;导致2-羟基戊二酸(2-HG)和延胡索酸(Fumarate)的含量明显升高,而乙酰辅酶A的水平明显降低。因此,C1qbp缺失的CD8+T细胞的DNA甲基化水平升高,与效应T细胞分化相关标志基因的H3K27ac水平降低而H3K27me3水平升高,从而造成这些基因转录水平下调,效应细胞的分化受到阻碍。
为了进一步确认代谢产物的改变是否影响效应细胞的分化,研究人员用延胡索酸处理野生型CD8+T细胞,该处理显著地抑制了效应CD8+T细胞的分化,使其更倾向于形成记忆前体细胞,而且CD8+T细胞分泌效应细胞因子的能力受到显著抑制,这在一定程度上模拟了C1qbp缺失CD8+T细胞的效应T细胞分化缺陷表型。而用组蛋白脱乙酰基酶抑制剂(tubastatin A)和醋酸盐(acetate)同时处理细胞,能显著回补C1qbp缺失CD8+T细胞分化成效应细胞和分泌效应细胞因子的缺陷。
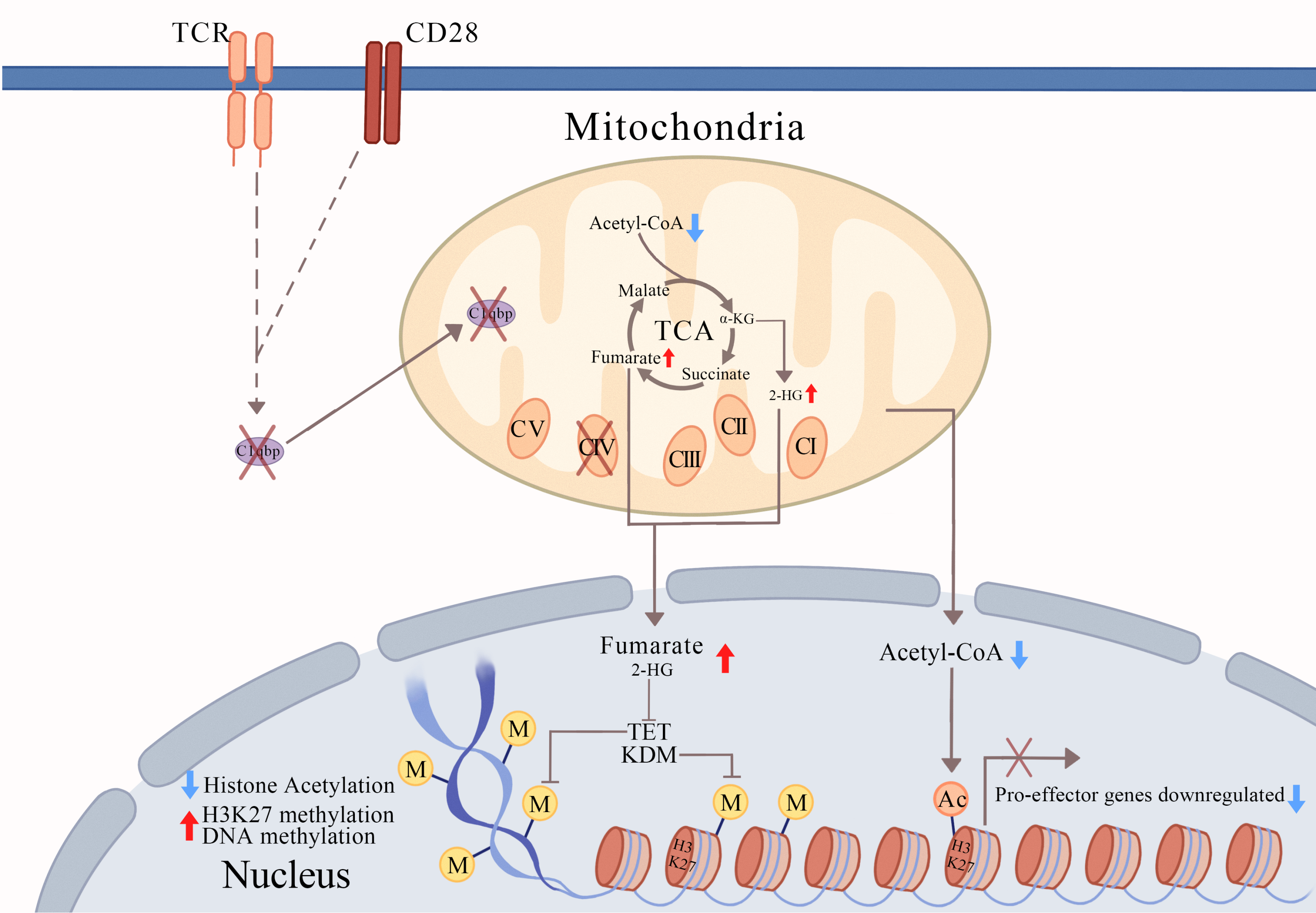
该研究首次报道了线粒体C1qbp能通过代谢-表观重编程促进效应CD8+T细胞分化,突出了线粒体在CD8+T细胞分化和功能中的关键作用,并且指出代谢干预可能提高癌症等疾病的T细胞治疗效果。
我室博士生翟星源、刘恺和医学院博士生房洪坤是论文的共同第一作者。生命科学学院肖能明教授和医学院李奇渊教授是本文的共同通讯作者。该研究得到了厦门大学生物医学仪器共享平台和实验动物中心的大力支持,并受到国家自然科学基金、高层次人才青年项目和中央高校基本科研业务费等的资助。
肖能明教授致力于抗病毒、抗肿瘤T细胞免疫的研究,以(共同)第一作者或(共同)通讯作者身份在Nature Immunology、Science Advances、Blood、pNAS、J Immunol、Front Immunol等重要学术期刊上发表多篇研究论文。课题组拟招聘博士后,招收博士生和硕士生若干名加入团队开展肿瘤免疫研究,欢迎感兴趣者通过邮件联系([email protected])。
原文全文链接:https://www.science.org/doi/10.1126/sciadv.abk0490
(图/文肖能明课题组)






























