【文献速递】Nature Communications探索合子基因的奥秘
来自受精卵的疑惑
你是否好奇过,受精过程中基因的表达由父本还是母本操控?你又是否迷惑过,受精卵何时开始表达合子基因,这一过程又如何开始?
来自德国马普研究所的Nicola Iovino研究团队,近日发表在Nature Communications上的研究Histone variant H2A.Z regulates zygotic genome activation为我们揭示了这一过程。研究表明,在受精过程中,所有的细胞过程都是由母体提供的mRNA和蛋白质控制的。合子基因组的转录在受精后数小时至数天内开始发生,这一过程被称为合子基因组激活(ZGA)。尽管在ZGA过程中,Zelda (先驱因子)已被证明十分重要,但是仍有数千个基因的表达与Zelda无关。Nicola Iovino团队通过对果蝇胚胎进行 GRO-seq、HiC 和 ChIp-seq等分析,发现高达 65%被激活的合子基因与组蛋白变体 H2A.Z相关,说明H2A.Z在合子基因激活表达的过程中至关重要。
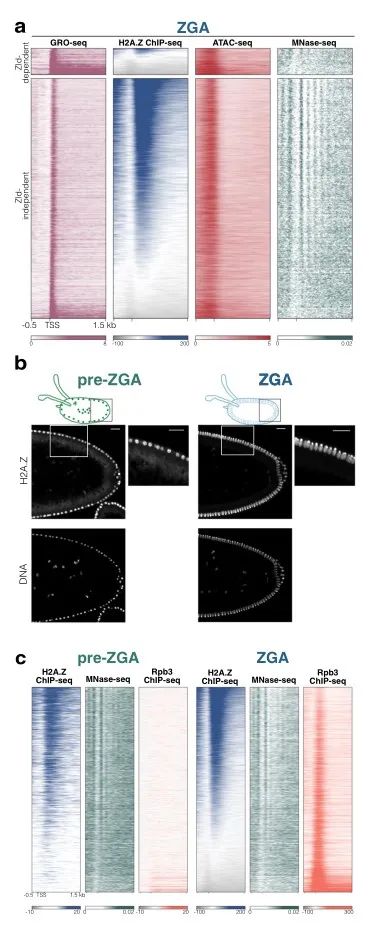
首先,作者通过GRO-seq分析了处于ZGA时期的合子转录本,发现了6249个关键基因,且其中5680个基因不依赖于Zelda进行激活转录;通过ChIp-seq,ATAC-SEQ,MNase-seq确定了这些基因的转录起始位点大量富集H2A.Z,如图1a所示。作者通过免疫荧光和ChIp-seq等方法,进一步确认H2A.Z在转录起始位点的累积发生于ZGA之前,也发生在RNA聚合酶结合之前,如图1b,c所示。那么H2A.Z的沉积受谁的影响呢?
图1. H2A.Z在ZGA之前沉积在活性转录起始位点上。a. GRO-seq, ChIp-seq, ATAC-seq, MNase-seq结果,颜色深浅代表为H2A.Z的信号强弱。b.免疫荧光观察H2A.Z定位。c. ChIp-seq,和MNase-seq检测H2A.Z的沉积出现在ZGA时期之前,并早于RNA聚合酶的结合。
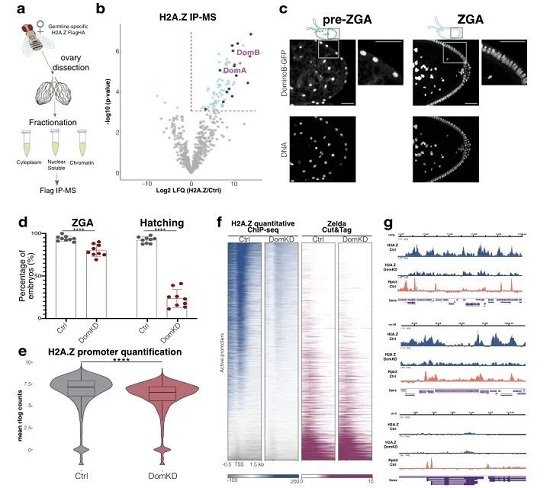
随后,研究人员通过Ip-MS发现了和H2A.Z互作的伴侣蛋白Domino。免疫荧光结果显示Domino在进入ZGA时期之前就在细胞核中富集了,这与H2A.Z高度一致。Domino敲低突变体DomKD中,70%的胚胎不能进入ZGA时期进而完成发育。定量ChIp发现DomKD胚胎中激活的启动子区域的H2A.Z减少了43%-57%。如图2所示。这些结果都说明Domino作为H2A.Z的伴侣蛋白,对其在ZGA期间结合到转录起始位点至关重要。那么Domino敲低引起的H2A.Z减少对于相关合子基因会有什么样的影响呢?
图2. Domino是H2A.Z沉积在TSS上主要的伴侣蛋白。a. Ip-MS实验模式图 b. H2A.Z Ip-MS结果图,蓝色部分为差异表达蛋白。DomA和DomB为Domino的异构体。c. Domino与核酸的共定位。d. DomKD胚胎发育统计。e. H2A.Z的定量ChIp平均rlog转换计数小提琴图。f. 启动子区域上H2A.Z的定量ChIp-seq信号。g.通过Integrative Genomics Viewer对定量ChIp-seq信号分体。
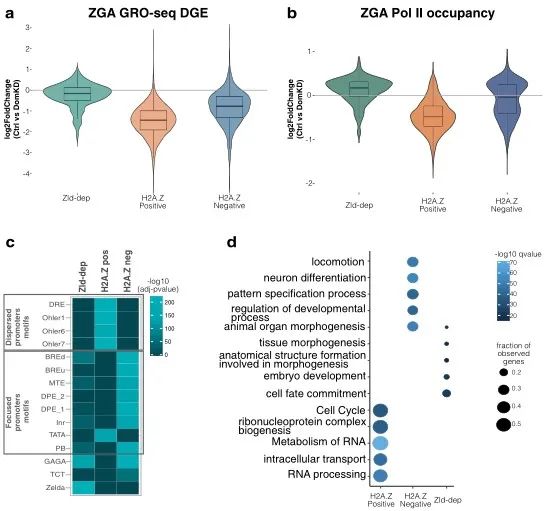
紧接着,研究人员证明了在DomKD中,H2A.Z阳性的基因转录水平显著降低,同时在该区域的启动子上,RNA聚合酶的结合率也会随之下降。并且,通过启动子核心原件的基序分析发现,H2A.Z阳性基因和H2A.Z阴性基因包含了不同的核心启动子元件基序,表达不同的基因。H2A.Z阳性相关基因和细胞周期、RNA代谢等基本过程相关(管家基因),而H2A.Z阴性和发育相关。综合来看,Domino的敲低会通过影响H2A.Z的富集进而影响管家基因的表达。如图3所示。Domino只会影响基因的表达吗?在ZGA时期,染色体会发生重排,这一过程是否也被影响呢?
图3. DomKD胚胎中管家基因的转录会被影响。 a. GRO-seq中在Zld依赖,H2A.Z阳性和H2A.Z阴性的差异表达基因。b. RNA聚合酶在Zld依赖,H2A.Z阳性和H2A.Z阴性中与染色体的结合情况。c. Zld依赖,H2A.Z阳性和H2A.Z阴性的核心启动子元件基序分析。d. Zld依赖,H2A.Z阳性和H2A.Z阴性 相关基因功能分析。
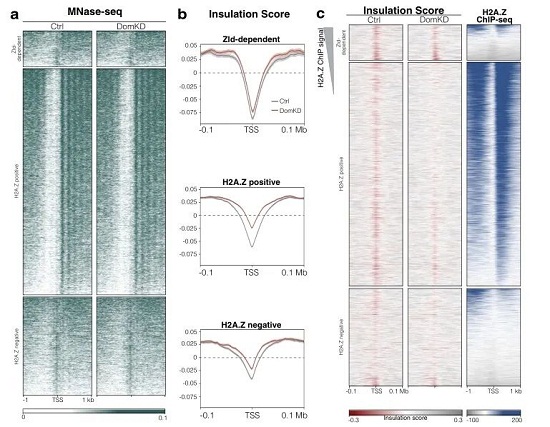
最后,研究者通过MNase-seq以及TAD分析(通过该三维结构的绝缘分数评定三维结构的完整性。)说明了Domino的敲低会影响到TAD结构即染色体组装。如图4所示。
综合以上研究内容,研究者认为H2A.Z对于ZGA过程中通过染色体重组进行转录程序的建立至关重要。
图4.正确建立TADs的边界需要Domino。a. MNase-seq分析对照和DomKD胚胎中Zld依赖,H2A.Z阳性和H2A.Z阴性基因的信号热图。b. Zld依赖,H2A.Z阳性和H2A.Z阴性的基因元件其绝缘度评分。c. 以H2A.Z信号为依据的绝缘评分热图。
在该研究中,我们不难发现作者高频的使用了ChIp(染色质免疫共沉淀)这一方法。ChIp作为研究生理状态下DNA与蛋白质互作的实验技术,主要用于表观遗传学研究以及转录因子调控机制研究。样本制备是影响ChIp实验数据灵敏度和重复性的一个关键因素,其难点之一在于染色质片段化的大小是否合适,一般情况下,300-600bp能获得较好的ChIp结果。文中使用的Covaris E220非接触式聚焦超声系统,能够准备的将染色质片段化为300-600bp,且剪切过程恒定低温、无需暂停,可有效保护抗原表位的完整性,提高后续Ip效率。非接触式的超声处理,可有效防止交叉污染。Covaris E220 非接触式聚焦超声系统通量灵活,兼容96孔板进行高通量的低体积染色质剪切;1ml 体系下,可处理1-24个样本。提供快速、高效、可重复的ChIp 解决方案的Covaris 聚焦超声系统,希望可以帮助有同样需求的您!
Covaris E220
Covaris 应对不同通量和不同样品量推出了一系列型号,总有一款适合您!
戳下图获得更多一手资料吧~