《Nature Medicine》福奇团队的mRNA HIV疫苗动物实验安全有效
在12月10日发表在《自然医学》上的一项新研究中,美国国立卫生研究院(NIH)下属的国家过敏和传染病研究所(NIAID)的一个研究团队表明,基于mRNA实验性HIV疫苗的研究已在小鼠和非人灵长类动物中显示出安全性和有效性。
这种疫苗可以触发抗HIV样病毒所需的抗体和细胞免疫反应。
与未接种的动物相比,在接受初始免疫和多次强化免疫的恒河猴中,感染猿类的人类免疫缺陷嵌合病毒(SHIV)的风险降低了79%。

该研究的共同负责人、NIAID主任安东尼·福奇博士说:“尽管全球科学界已经努力了近40年,但有效预防艾滋病毒的疫苗仍然是一个难以实现的目标。
mRNA疫苗结合了几个特点,可以克服其他试验性艾滋病疫苗的缺点,所以它是一种很有前途的方法。”
实验疫苗的工作原理与新型冠状病毒mRNA疫苗相似。
然而,该疫苗不携带新型冠状病毒刺突蛋白的mRNA指令,而是提供了两种关键HIV蛋白的编码指令,Env和Gag。
接种疫苗的动物的肌肉细胞将这两种蛋白质组装在一起,产生病毒样颗粒(VLps),其表面散布着大量的Env副本。
虽然由于缺乏HIV的完整基因编码,它们不会引起感染,但这些VLps在刺激适当的免疫反应方面与感染的完整HIV相匹配。
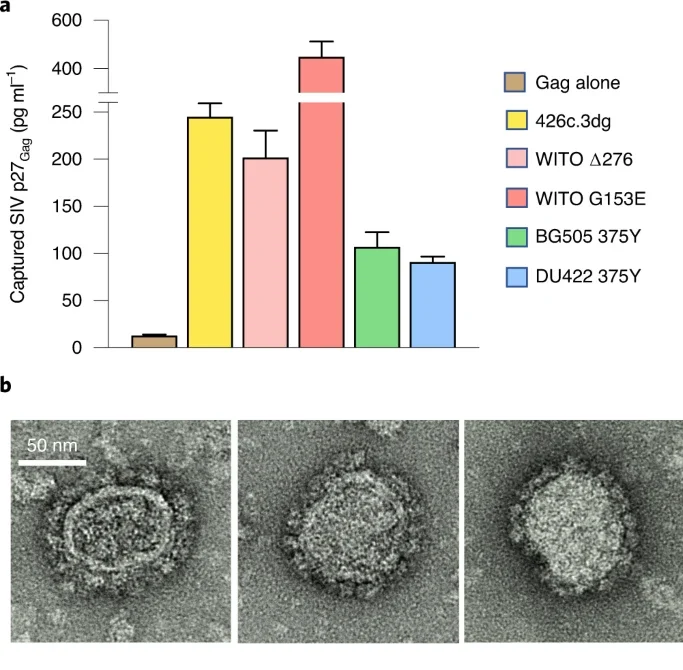
研究人员报告说,在对小鼠的研究中,两次注射形成VLps的mRNA疫苗可以在所有动物中诱导产生中和抗体。
根据mRNA指令在小鼠体内产生的Env蛋白与整个病毒中产生的蛋白非常相似,这是对之前实验HIV疫苗的改进。
该研究的共同通讯作者保罗·卢索博士说:“在每个VLp上显示多个HIV包膜蛋白的真实副本是我们平台的一项特殊功能。它与自然感染非常相似,并可能在引发预期的免疫反应中发挥作用。”
研究小组随后在恒河猴身上测试了Env-Gag VLp mRNA疫苗。
不同亚组的动物接种疫苗的细节各不相同,但都涉及用一种经过修改以优化抗体产生的疫苗启动免疫系统。
第一阶段开始后,在一年内进行了几次强化疫苗接种。
除了用于初始疫苗的基因外,加强疫苗还包含来自HIV进化两个分支的Gag mRNA和Env mRNA。
研究人员使用多种病毒变体优先激活抗体,以对抗Env中更保守的“共享”区域(广泛中和抗体的目标),而不是每个毒株中更不同的可变区域。
研究人员说,尽管传递的mRNA剂量很高,但疫苗的耐受性很好,只有轻微和暂时的不良反应,如食欲不振,在恒河猴中发生。
到第58周,所有接种过疫苗的猕猴在12种不同HIV毒株的测试小组中对大多数毒株产生了可测量水平的中和抗体。
除了中和抗体外,VLp mRNA疫苗还诱导了强大的辅助T细胞反应。
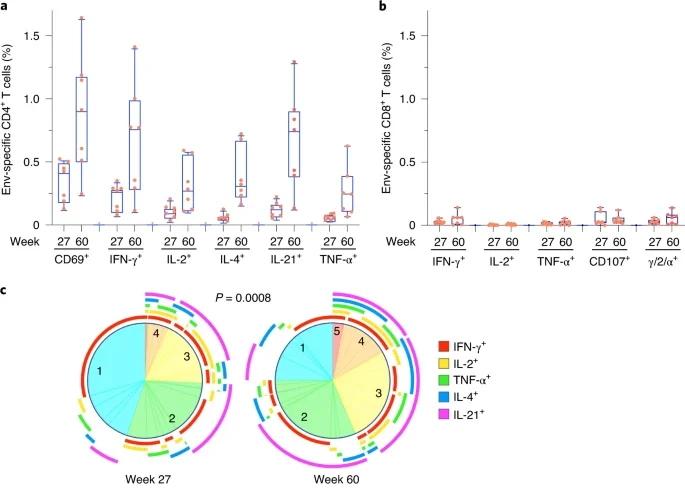
从第60周开始,免疫和非免疫对照组的恒河猴每周通过直肠黏膜暴露于SIV。
由于非人类灵长类动物不容易感染HIV-1,科学家们在实验环境中使用了嵌合的SHIV,这种病毒可以在恒河猴身上复制。
接种13周后,7只免疫恒河猴中有2只未感染。
其他免疫动物的感染总体上是延迟的,感染发生在平均8周。相比之下,未接种疫苗的动物平均三周后就会感染。
卢索说:“我们现在正在改进疫苗项目,以提高VLps生产的质量和数量。
这可能进一步提高疫苗的效力,从而减少产生强烈免疫反应所需的初始免疫和增强剂的剂量。
如果被证明是安全有效的,我们计划在健康的成年志愿者中进行疫苗平台的第一阶段试验。”






























