张宏权团队发现新型组蛋白翻译后修饰类型异烟酰化修饰
2021年9月20日,北京大学基础医学院、国际癌症研究院张宏权教授团队在Nature Communications杂志在线发表了题为“Isonicotinylation is a histone mark induced by the anti-tuberculosis first-line drug isoniazid”的研究论文,首次发现了组蛋白异烟酰化修饰 (Isonicotinylation) 这种新型的蛋白质翻译后修饰类型,并对调控该修饰的酶系统及生物学功能进行了探究。
近年来,组蛋白翻译后修饰(pTMs)因其能够通过改变染色质结构进而调控基因转录和表达,已成为表观遗传研究热点之一。目前发表的研究报道已鉴定到多种组蛋白翻译后修饰类型并对其开展了深入研究,对于其它未被发现的组蛋白翻译后修饰类型的探索仍在进行中。
团队研究人员发现,组蛋白异烟酰化修饰是一种在真核细胞中高度保守的翻译后修饰类型,一线抗结核药物异烟肼进入细胞内可直接或经其下游代谢产物异烟酸转化为异烟酰辅酶A调控细胞内异烟酰化修饰水平;组蛋白乙酰转移酶CBp/p300可以发挥组蛋白异烟酰转移酶的作用,组蛋白去乙酰化酶HDAC3能够发挥组蛋白去异烟酰化酶的作用。在基因转录调控方面,组蛋白异烟酰化修饰能够开放染色质结构,促进部分基因转录进而影响多种信号通路。本研究还发现组蛋白异烟酰化修饰能够通过促进pIK3R1基因转录进而提高pIK3R1蛋白水平从而激活pI3K/Akt/mTOR信号通路,促进肝细胞癌的发生发展。
该研究发现的组蛋白异烟酰化修饰丰富了组蛋白翻译后修饰的内容,并首次发现吡啶基团可以被引入组蛋白的修饰中。由于含吡啶结构的化学物质是重要的制药和化工原料,因而在染色质中引入含吡啶结构的异烟酰化修饰,其长期效果将具有重要的公共卫生意义。此外,异烟肼作为治疗肺结核病人的首选药物之一,其诱导的组蛋白异烟酰化修饰将为异烟肼治疗所导致的多种毒副作用和致癌风险机制的阐明提供了新的科学依据。
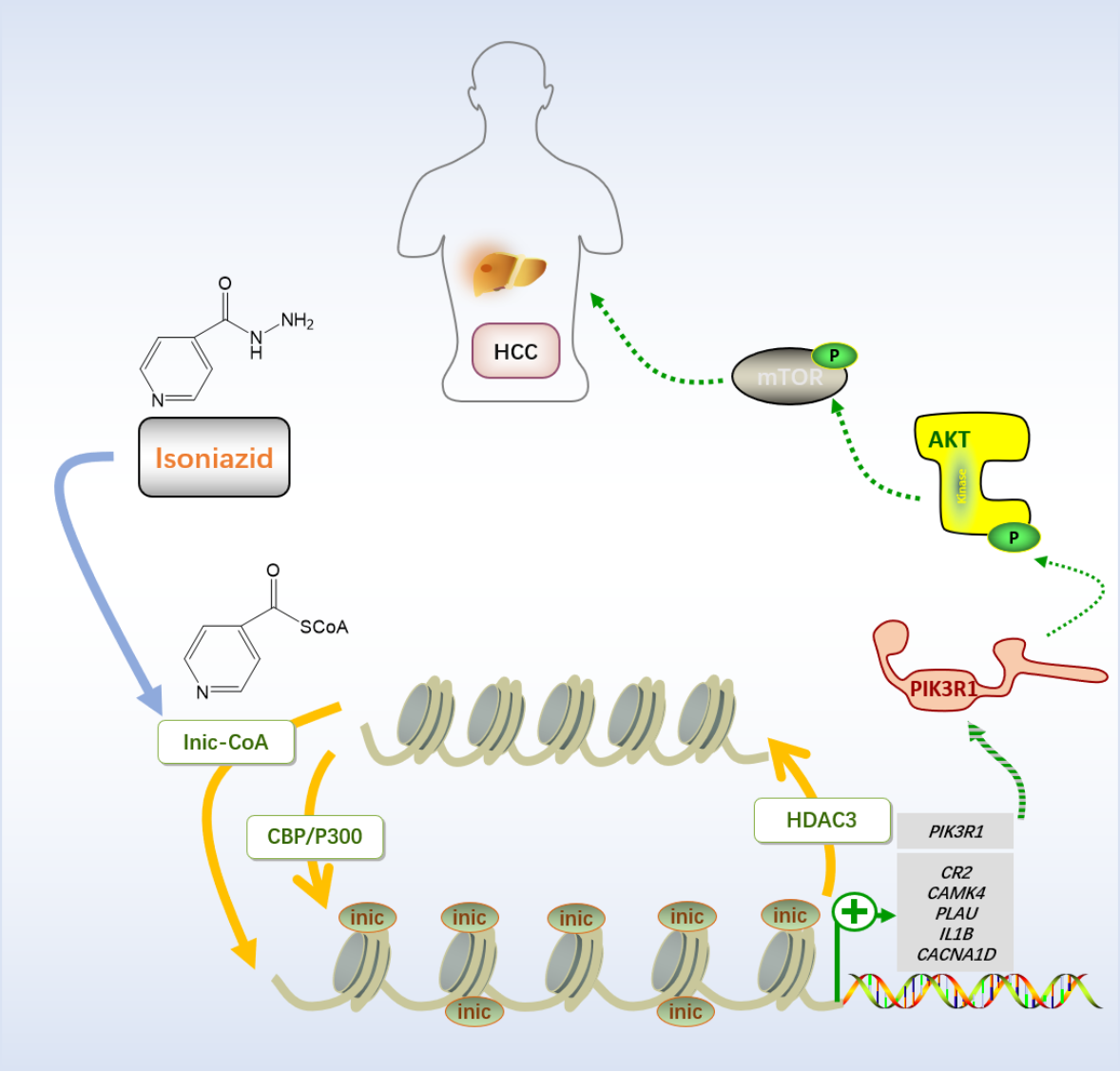
工作模型显示异烟肼(INH)可以通过转化为异烟酰辅酶A(Inic-CoA)的方式进入细胞核,在CBp/p300的作用下Inic-CoA作为前体将异烟酰基团转移至组蛋白,发生组蛋白异烟酰化修饰,且可以在HDAC3的作用下去异烟酰化修饰。组蛋白发生异烟酰化修饰后开放染色质结构,促进pIK3R1基因转录,提高pIK3R1蛋白水平,激活pI3K/Akt/mTOR信号通路,促进肝细胞癌(HCC)的发生发展。
北京大学基础医学院博士研究生蒋瑀涵为本文的第一作者,北京大学基础医学院人体解剖与组织胚胎学系张宏权教授为通讯作者。研究过程中得到了北京大学基础医学院病原生物学系陈香梅副教授、杭州景杰生物科技股份有限公司翁叶靖博士和程仲毅博士的帮助。该研究受国家自然科学基金委员会重点项目、科技部重大基础研究专项、北京市自然科学基金重点项目及北京大学重点基础研究专项的支持。
论文链接:https://www.nature.com/articles/s41467-021-25867-y
(北京大学基础医学院)






























