周斌组在Trends in Cell Biology发表双同源重组系统的综述论文
10月15日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究员在国际学术期刊Trends in Cell Biology发表了题为“Harnessing orthogonal recombinases to decipher cell fate with enhanced precision”的综述文章。该文章系统地回顾了正交双同源重组酶系统遗传学操作的发展历程,深入讨论了双同源重组酶系统在各个器官与系统中的应用如何弥补了单同源重组酶系统的局限进而厘清了各领域内的争议问题,并且展望了正交同源重组酶系统未来的发展方向和新的研究思路。
Cre-loxp同源重组系统是在多种模式生物,尤其是小鼠中,广泛应用的遗传学操作系统。Cre重组酶能够识别loxp DNA序列并进行DNA序列插入、删除和反转操作。Cre-loxp系统常用于基因的条件型敲除或者重组删除STOp cassette来启动转基因,例如报告基因的表达。尽管其已经发展成为组织特异性与可诱导型的系统,Cre-loxp系统依然存在一些局限性并且导致了一些研究中实验结果的误读。与此同时,多种特异位点重组酶系统,例如Flp-frt、Dre-rox等在噬菌体等生物中被发现。在神经生物学领域中,Susan Dymecki等最早联用Cre和Flp两种特异位点重组酶来精确示踪,发现了中央神经系统中脉络丛和顶板结构的发育来源。由此开始,双同源重组系统被逐步应用到多个研究领域中。该综述以c-Kit+心肌干细胞的为例,聚焦于单重组酶系统依赖于单个基因调控元件的低特异性问题。c-Kit阳性的干细胞曾经被报道为内源性成体心脏干细胞,能够分化为包括心肌细胞在内的多种细胞,为心血管疾病的治疗带来了希望。然而,三个研究组分别使用基于c-Kit的谱系示踪工具并没能发现成年小鼠中c-Kit细胞的成心肌能力。为了厘清这一问题,周斌研究课题组利用Cre和Dre两种重组酶激活的双同源重组系统(DeaLT)来排除传统谱系示踪技术示踪c-Kit成体干细胞时对于心肌细胞的异位标记,实现了心肌细胞和cKit+非心肌细胞同时不可逆标记,从而精确地得出c-Kit阳性成体哺乳动物非心肌细胞在生理或病理情况下均不能发生向心肌细胞转变的结论。DeaLT后续同样被用于探寻所有非心肌细胞向心肌细胞的转变,成体肝细胞和胆管上皮细胞转化的可塑性,新生beta细胞的来源等各种需要同时精准示踪多种细胞类型的问题。
随着单细胞转录组学等技术发展,同一细胞类型内的异质性被越来越清晰地认知。双同源重组系统的选择性标记能力也使得研究者能够使用两个标记基因以不同的遗传学构造靶向它们的交集、补集或同时实现多个亚群的标记。通过构造新的基于Cre和Dre双同源重组酶的遗传学策略,周斌研究课题组实现了对于Sca1+细胞中的Sca1与pDGFRa或pDGFRb两群双阳性细胞的谱系示踪,确认了Sca1+ 细胞在动脉平滑肌修复中的作用,并且揭示了Sca1+细胞亚群中各异的平滑肌修复能力。类似方法也被用于脂肪细胞前体细胞和气管肺泡干细胞等细胞群的命运分析,以及神经系统中神经异质性和神经环路的标记。pDGFRa与pDGFRb双阳性与单阳性亚群只有使用双同源重组系统才能够进行同时地标记并平行分析,从而直接就三种细胞亚群对于新生脂肪细胞的贡献进行比较。传统方法也无法特异标记同时表达Club和AT2细胞标记基因CC10和SpC的气管-肺泡干细胞(BASCs),而研究人员通过双同源重组系统和Split-Cre系统分别独立对BASCs进行谱系示踪并就其对于肺损伤的修复贡献进行了探究。Josh Huang等则通过联用脑区域病毒注射、Cre与Flp双同源重组系统和Tet-On系统等,实现了通过神经连接、脑区位置、基因表达谱、发育时期和来源等多种维度的亚群标记GABA能神经元,对于揭示其各异的功能具有重大意义。
为了更好地研究目标细胞的生理功能与机制,特定细胞亚群的基因敲除或者细胞清除也可以通过双同源重组系统实现,弥补了广泛基因敲除或细胞清除不特异在研究细胞亚群功能中的缺陷。周斌研究课题组通过plin1-dCreER策略实现了靶向无特异标记基因的白色脂肪细胞亚群(WAT)的Cre活性,从而实现在WAT中转录因子ppARγ的编码基因的敲除。此外,Wt1-CrexER通过Dre重组膜定位雌激素受体(ER)序列而将诱导型CreER转化为持续性的Cre,从而在心脏中特异性敲除内皮细胞中的VEGFR2,造成了心脏血管生成障碍。而另一研究通过Flp激活的Cre进行Rbpj敲除也抑制了动脉的分化,细致地探究了血管生成和分化过程中的分子调控机制。以上系统最终的效应重组酶都是Cre,因此可以兼容以往为Cre设计的多种细胞探针或者报告基因。在细胞层面上,双同源重组系统在脊髓背侧兴奋性或抑制性神经元中启动白喉毒素受体(DTR)表达来介导特定神经元的清除,直观地展示了这两种神经元在痛觉感受神经回路中的不同作用,完善了对于痛觉感受通路的了解。胰岛beta细胞特异的DTR表达和细胞清除也使得少数非beta细胞群分泌多种激素的可塑性得到揭示。
除了利用双同源重组系统高效而精准地实现细胞亚群中的基因敲除与细胞清除,多种双同源重组系统构造策略也已经实现对于短暂性细胞状态的无缝隙捕捉。Lgals-rox-STOp-rox-Cre的STOp在平滑肌细胞中被Dre重组,从而在Lgals3表达时启动Cre。即使这一基因在细胞转移完成后不再表达,也能实现所有Lgals3+平滑肌细胞的标记。揭示了平滑肌细胞在动脉粥样硬化损伤修复中短暂表达Lgals3并首先移动到损伤处的过程。类似地,Kit-CreER通过切割Vimentin-LSL-Dre和N-Cadherin-LSL-Dre的STOp cassette,使得Dre可以在luminal细胞发生EMT时表达,帮助揭示这些基因在乳腺癌细胞发生上皮-间质细胞转移时的作用和分子机制。研究生理环境下的短暂的细胞状态差异例如细胞周期的改变同样是非常重要的,而在肝细胞、心肌细胞或神经元中细胞周期活动都比较稀少和复杂。用传统的核酸类似物掺入或者免疫荧光染色检测这些细胞的增殖都会有信噪比低、可追踪时间不长等问题,并会受到增殖更旺盛的巨噬或内皮等细胞的干扰。而基于单分子的长期谱系示踪则局限于某些细胞亚群,不同的研究人员曾经提出Axin2+中央静脉周围肝细胞、Sox9+门静脉周围肝细胞理论或分散的Terthigh肝细胞具有增殖优势。但是,利用Ki67-CrexER,周斌研究课题组实现了所有细胞类型或者肝细胞特异的增殖信息长时程、不间断的记录。而基于Ki67-CrexER的proTracer可以看到Zone 2的肝细胞荧光标记数量尤其高,指征这一区域的增殖优势。
该综述总结了多种类型的位点特异性重组酶及其遗传学操作特点,还总结了各种正交同源重组系统的设计思路。尽管双同源重组系统拥有揭示丰富的细胞和分子层面信息的能力,但其转基因小鼠构造复杂程度较高,并且受到位点特异型重组酶本身特性的掣肘,在实际应用中依然存在一些问题。该综述总结了重组酶非特异活性及双同源重组系统转基因小鼠构造繁琐等缺点,并提示了未来突破以上问题和提高正交同源重组酶在各种细胞类型或状态的准确标记和遗传学操作能力的研究方向。此外,本文也展望了未来正交同源重组系统用于细胞间接触或是各种细胞程序性死亡后标记的研究方向。
中国科学院分子细胞科学卓越创新中心周斌研究组博士研究生翁文栋和刘秀秀为本文的共同第一作者,周斌研究员为本文的通讯作者。该项工作得到了香港中文大学医学院的Kathy O. Lui教授的大力支持,以及来自中科院、基金委、科技部以及上海市科委等部门的经费支持。
文章链接:https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(21)00186-0
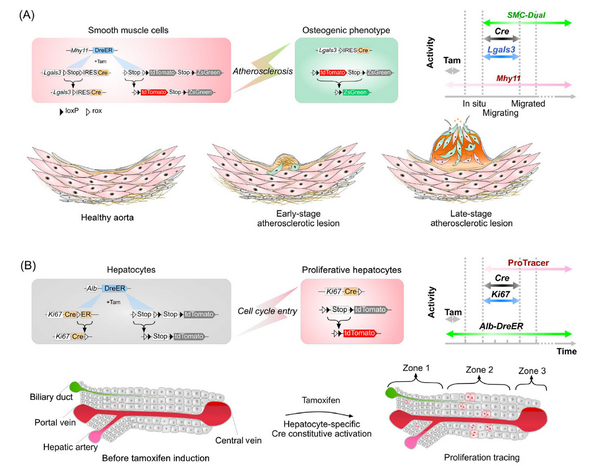
利用双同源重组酶实现长时程不间断记录细胞事件






























