北大学者Blood发文:皮肤T细胞淋巴瘤大细胞转化的分子机制以及新型治疗靶点
2021年9月28日,北京大学第一医院皮肤科汪旸教授团队与北京大学生物医学前沿创新中心任仙文研究员合作在Blood在线发表了题为“pEG10 amplification at 7q21.3 potentiates large-cell transformation in cutaneous T-cell lymphoma”的研究论文,首次阐述了pEG10基因的拷贝数扩增在皮肤T细胞淋巴瘤大细胞转化的关键作用及机制,为皮肤T细胞淋巴瘤大细胞转化的诊治提供了新的理论基础和潜在治疗靶点。
论文截图
原发性皮肤T细胞淋巴瘤是一类皮肤归巢T细胞起源的非霍奇金淋巴瘤,存在多种临床亚型。蕈样肉芽肿是其中最常见的类型。近年来皮肤T细胞淋巴瘤的发病率在快速增长,在结外非霍奇金淋巴瘤中已经升至第二位。虽然大部分皮肤T细胞淋巴瘤主要呈惰性隐匿性的病程,20%—55%的患者病情进展相对较快,其肿瘤细胞在组织形态上从小细胞转变为大细胞,大于正常小淋巴细胞的4倍,并且大细胞的比例超过25%或者形成小结节,称为皮肤T细胞淋巴瘤的大细胞转化(LCT)。发生LCT代表肿瘤性T细胞处于高度恶性的状态,患者病程往往呈侵袭性,对常规治疗抵抗,预后很差。然而,目前皮肤T细胞淋巴瘤发生LCT的原因及具体分子作用机制还存在诸多空白,尚无有效控制LCT的治疗手段。因此,深入研究皮肤T细胞淋巴瘤LCT的关键分子调控机制,对于寻找潜在治疗靶点、延缓疾病进展和改善患者预后具有重要的临床意义。
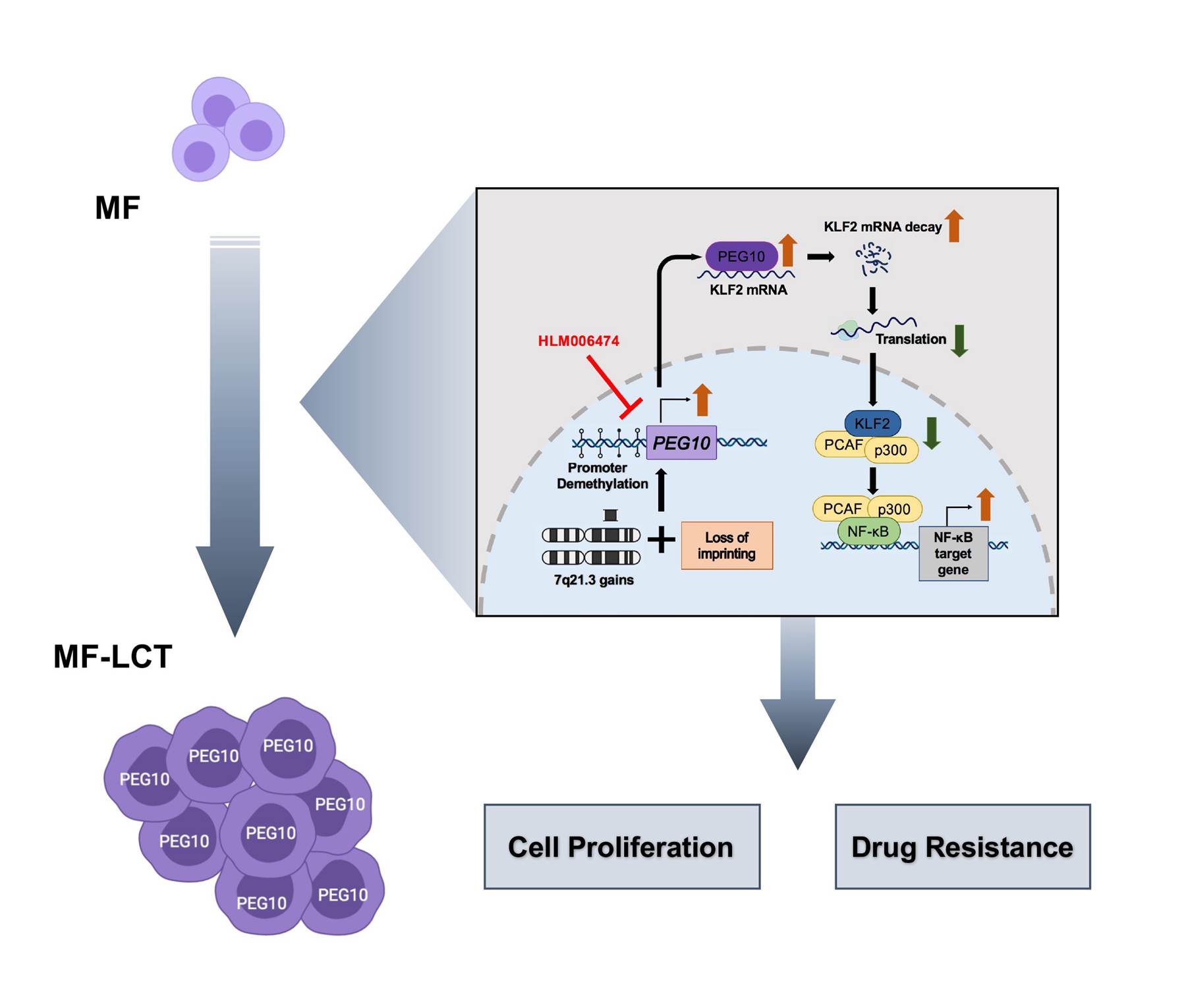
在本项研究中,课题组首先通过对发生了LCT的和未发生LCT的肿瘤期皮肤T细胞淋巴瘤肿瘤样本进行RNA测序,揭示了与LCT恶性表型相关的转录表达模式。接着通过整合转录水平的分子表达异常和基因水平的拷贝数变异推测,发现pEG10这一印记基因在LCT的标本中的特异性高表达及其与疾病不良预后之间的关系。通过DNA荧光原位杂交、甲基化质谱检测以及等位基因表达分析,作者发现pEG10所在的染色体7q21.3的扩增、pEG10启动子区低甲基化和丢失印记是导致pEG10在LCT中表达上调的重要调控机制。接下来,通过一系列体内和体外研究,作者阐明了pEG10是调控皮肤T细胞淋巴瘤LCT转录表达模式及恶性细胞表型的关键因子。pEG10能够促进皮肤T细胞淋巴瘤细胞生长优势以及对两种治疗药物(组蛋白去乙酰化酶抑制剂和蛋白酶体抑制剂)的抵抗作用。这一机制可由pEG10/KLF2/NF-kB轴介导,即pEG10通过结合KLF2基因的mRNA来抑制其稳定性,从而导致KLF2 mRNA水平下调。而下调的KLF2蛋白可以通过增强NF-kB的共激活复合体pCAF/p300和p65核内结合从而导致NF-kB转录活性的上调。最后,作者发现一种小分子化合物HLM006474可以通过抑制pEG10表达阻遏皮肤T细胞淋巴瘤细胞的生长,并与组蛋白去乙酰化酶抑制剂/蛋白酶体抑制剂产生协同性杀伤作用,有望成为晚期皮肤T细胞淋巴瘤的新型治疗手段。
作者简介:
北京大学第一医院皮肤科博士生刘凤洁为论文第一作者,北京大学第一医院皮肤科汪旸教授和北京大学生物医学前沿创新中心任仙文研究员为论文的共同通讯作者。
汪旸教授长期致力于皮肤淋巴瘤的临床和研究工作。带领团队在皮肤淋巴瘤的分子诊断和发病机制方面取得多项突破。获得国家自然科学基金优秀青年基金,入选中组部“万人计划”青年拔尖人才计划,北京市科技新星,首都十大杰出青年医生。现任国际皮肤淋巴瘤协会(International Society of Cutaneous Lymphoma, ISCL)执委,中国医师协会皮肤性病学分会皮肤肿瘤专业委员会副主任委员。
任仙文研究员现任北京大学生物医学前沿创新中心(BIOpIC)研究员。致力于单细胞转录组测序的生物信息学分析和肿瘤免疫的研究,针对大规模单细胞测序数据的聚类、注释、时空重建等重要前沿生物信息学问题提出了关键技术创新。






























