气液界面的电荷性质决定冷冻电镜蛋白质取向优势
2021年8月25日,中国科学院生物物理研究所章新政研究员课题组在结构生物学期刊《Journal of Structural Biology》在线发表了题为"Effect of charge on protein preferred orientation at the air-water interface in cryo-electron microscopy"的冷冻电镜方法学研究论文。该研究成果首次提出了电荷相互作用是蛋白颗粒吸附于气液界面并且导致取向优势的主要因素,为克服气液界面导致的冷冻制样问题提供了新的思路。
冷冻电镜三维重构需要蛋白质在冷冻制样时取向随机的分布在非晶冰中,然而气液界面常常导致蛋白质,特别是可溶性蛋白质在非晶冰中出现优势取向分布,严重情况下使得三维数据不完整,无法进行重构,是目前单颗粒冷冻电镜技术对蛋白质进行结构解析时易遇到的主要瓶颈问题。前期研究表明,气液界面具有疏水性,可以使得处于气液界面上的蛋白质变性。因此,气液界面往往被认为通过疏水相互作用吸附部分变性的蛋白质,从而导致优势取向问题。
中国科学院生物物理研究所章新政课题组李不凡针对冷冻电镜三维重构中常见的蛋白质优势取向问题开展机制研究,发现蛋白质吸附于气液界面,其取向由气液界面携带的电荷控制(图)。常规的冷冻制样中气液界面携带负电荷,负电荷对蛋白质的吸附导致了蛋白质分布的取向优势。研究还发现通过运用带正电的去污剂调制气液界面的电荷性质,可以引入蛋白质新的取向数据,实现蛋白质取向问题的改善。而这个工作提出了电荷相互作用是许多蛋白质吸附于气液界面的主要因素,为克服气液界面导致的冷冻制样问题提供了新的思路。
中国科学院生物物理研究所章新政课题组博士生李不凡为第一作者,章新政研究员为本文的通讯作者。本项目得到科技部国家重点研发计划、自然基金委重点项目、中国科学院战略性先导科技专项(B类)、中国科学院基础前沿科学研究计划项目的支持。
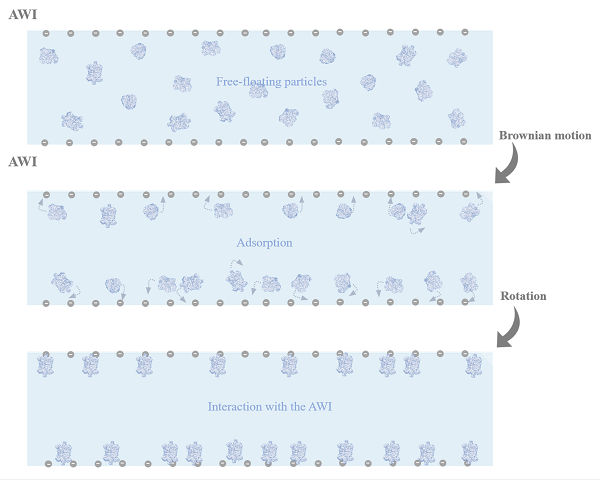
图. 蛋白质通过布朗运动至气液界面附近,被由带负电的气液界面形成的势阱捕获的示意图。捕获的过程为蛋白质的旋转使其在势阱中的能量最低。最低能量状态决定优势取向分布。
文章链接:https://www.sciencedirect.com/science/article/pii/S1047847721000885
(供稿:章新政研究组)






























