生命科学学院李程研究组与合作者揭示胎肝造血干细胞扩增功能单元“HSC PLUS”
血液作为生命的河流,源源不断地为机体提供营养物质和免疫保护。作为血液源头的造血干细胞,具有自我更新和多向分化的能力,不仅能够维持机体的终身造血,也是恶性血液疾病移植治疗的重要细胞来源[1, 2]。但是,造血干细胞来源不足却是限制其推广的瓶颈。如何扩增足够数量的功能性造血干细胞,一直是基础科学研究的难点和热点之一。在脊椎动物胚胎发育过程中,胎肝是造血干细胞扩增的天然场所。在这里造血干细胞进行快速的扩增,并能保持较强的干性[3, 4]。全面、系统、立体化地解析这一扩增性造血器官,将为体外扩增造血干细胞提供理论指导。
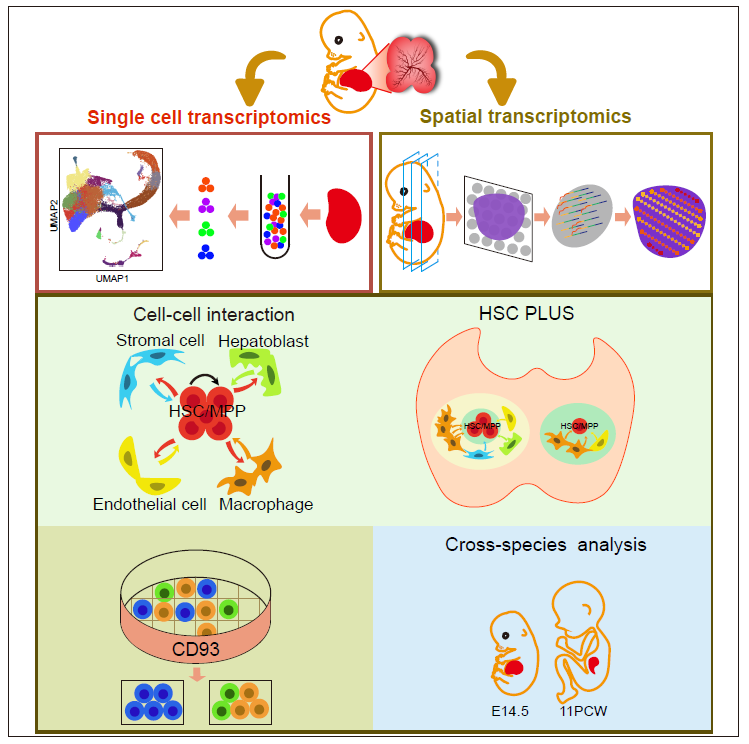
2021年8月2日,北京大学生命科学学院李程团队与中国科学院动物研究所刘峰团队合作在Cell Research 杂志发表题为Identification of HSC/Mpp expansion units in fetal liver by single-cell spatiotemporal transcriptomics的研究论文。该论文利用单细胞转录组和空间转录组联合分析的方法,绘制了小鼠胎肝发育的单细胞时空转录组图谱,解析了造血干/祖细胞的转录组和功能异质性,鉴定了造血干细胞扩增的功能单元(HSC 'pocket-like' units, HSC pLUS)并揭示其分子机制。

首先,研究人员通过单细胞转录组测序技术,绘制了胎肝血细胞和微环境细胞发育的转录组图谱,解析了造血干/祖细胞和微环境细胞的转录组动态变化。通过生物信息学分析和移植实验验证,研究人员发现CD93不仅可以富集干性较强的造血干/祖细胞,还是造血干/祖细胞发育的调控因子。随后,研究人员使用CellphoneDB方法构建了微环境细胞和造血干/祖细胞的互作调控网络,鉴定了潜在的促造血干细胞扩增分子,如生长因子MDK和pTN等。
胎肝造血干细胞扩增功能单元示意图
为了验证互作细胞和配对信号分子的空间关系,研究人员绘制了胎肝的空间转录组图谱。利用空间转录组数据具有空间坐标的特征,研究人员将微环境细胞和与造血干/祖细胞的空间关系分为Intra-spot(关系最密切)、Inter-spot(关系密切)和Others(关系疏远)三类。通过定性和定量分析,研究人员发现巨噬细胞高度富集在造血干/祖细胞周围,并且具有相邻关系的巨噬细胞和造血干/祖细胞分别表达互作分子对中的配体和受体。与此同时,免疫荧光实验数据显示巨噬细胞可以形成“口袋状”结构包围造血干/祖细胞,功能数据显示巨噬细胞及其分泌生长因子的促扩增作用。即扩增的造血干/祖细胞处于巨噬细胞和生长因子富集的HSC pLUS。众所周知,细胞是机体的最小功能单元,其次是组织/器官,本研究发现细胞和组织/器官之间存在细胞行为的特定功能单元,即造血干细胞扩增的基础功能单元(HSC pLUS)。
最后,通过将小鼠胎肝和已发表的人胎肝单细胞转录组数据比对分析,研究人员发现在人胎肝中也存在保守的扩增结构和分子机制。以上述高通量组学数据为基础,研究人员搭建了数据交互网站http://liulab.ioz.ac.cn/fetal_liver/,可以检索基因的时空表达谱,包括细胞类型以及空间位置等。
综上所述,该研究首次绘制了小鼠胎肝发育的单细胞时空转录组图谱,鉴定了造血组织功能单元(HSC pLUS),不仅加深了我们对体内造血干细胞扩增方式的理解,扩充了我们对组织功能单元的认识,也为造血干细胞体外扩增提供了更多线索。
中国科学院动物研究所刘峰研究员和北京大学生命科学学院李程研究员为本文共同通讯作者。中国科学院动物研究所博士研究生高素伟和北京大学生命科学学院石强博士为本文共同第一作者。该研究得到国家自然科学基金、国家重点研发计划等的资助,并得到北京大学“北极星”高性能计算平台的大力支持。
参考文献
1.Laurenti, E. and B. Gottgens, From haematopoietic stem cells to complex differentiation landscapes. Nature, 2018. 553(7689): p. 418-426.
2.Zhang, Y., et al., Hematopoietic Hierarchy - An Updated Roadmap. Trends Cell Biol, 2018. 28(12): p. 976-986.
3.Ema, H. and H. Nakauchi, Expansion of hematopoietic stem cells in the developing liver of a mouse embryo. Blood, 2000. 95(7): p. 2284-8.
4.Swain, A., et al., Intrinsic and extrinsic regulation of mammalian hematopoiesis in the fetal liver. Histol Histopathol, 2014. 29(9): p. 1077-82.






























