新发现一种催化化合物手性的天然酶
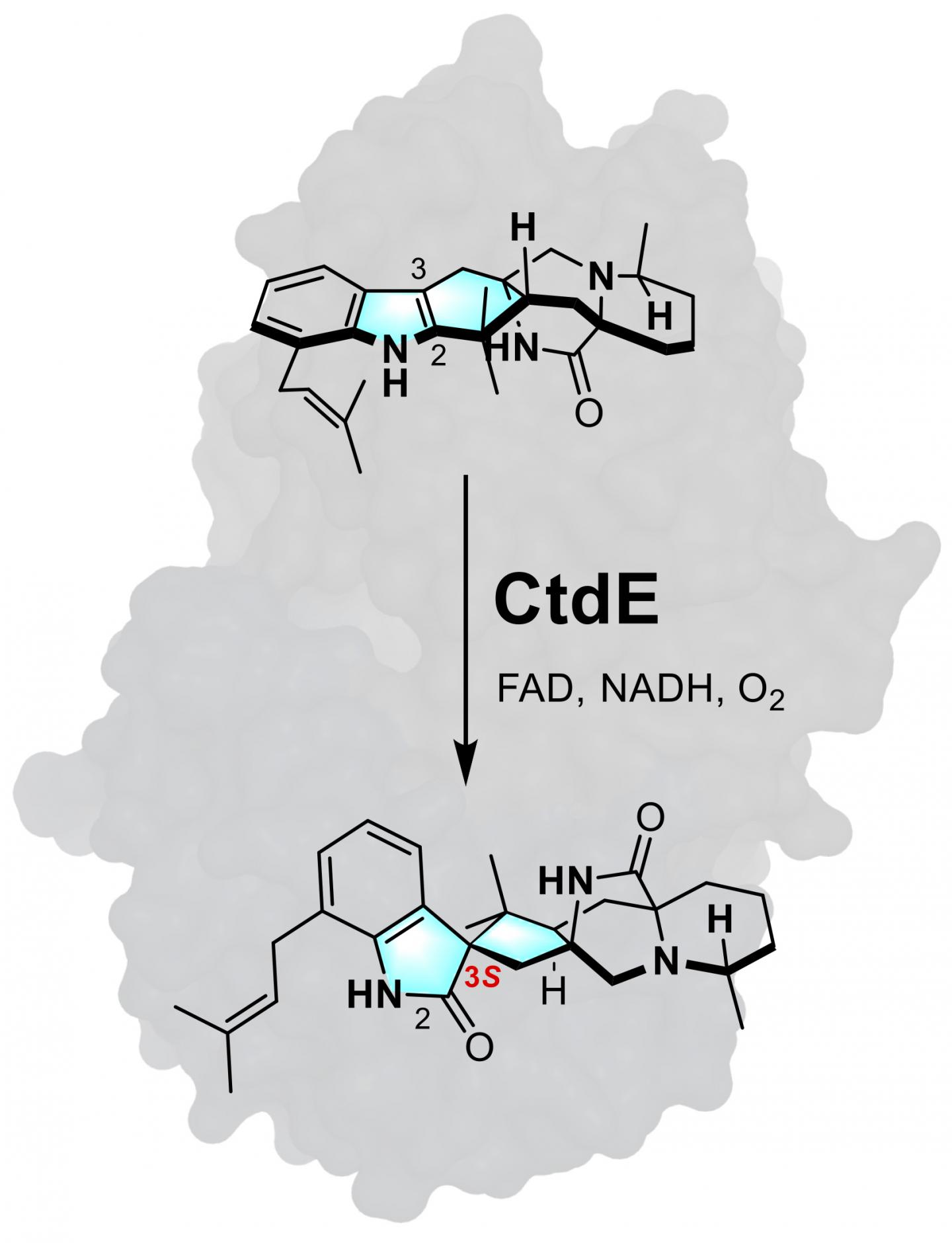
莱斯实验室的化学和生物分子工程师Xue Sherry Gao及其合作者分离出一种生物催化剂CtdE,确定它是控制天然真菌宿主产生的化合物的手性(左手或右手)的自然机制。
这项开放获取的研究发表在《自然通讯》上。
两个手性物体,就像手一样,结构相似,但不能完全重叠。因为这一特性对于设计能与靶点正确结合的药物很重要,所以达到100%正确手性的能力是非常需要的,Gao说。
她说:“这一点很重要,因为如果一种药物的立体化学(三维手性)错误,它可能会成为人类的毒药,即使平面化学结构是相同的。”
像手性物体中的“左”或“右”方向一样,所谓的3S或3R方向是由分子的立体中心决定的,即分子各部分之间的单原子连接。
但是,尽管自然界很容易处理这个过程,但选择性合成立体中心一直是化学家面临的挑战。大自然控制一个分子是3S取向还是3R取向的能力背后的整个机制直到现在都被隐藏在人们的视线之外。
了解它在真菌中的工作原理并分析其结构可以给科学家,特别是那些设计药物的科学家,提供一种新的化学合成工具。
这项研究的重点是一种生物活性天然产物21R-柠檬酸苷A(21R-citrinadin A),2004年在一种海洋来源的桔青霉菌株中发现,对小鼠白血病和人类肺癌细胞有毒性。
“21R-citrinadin A是一个非常复杂的分子,有八个立体中心,”Gao说。“在某种程度上,本文强调了自然界如何利用酶来合成如此精确的复杂分子。八个不同的立体中心很难控制。”
她说,这种分子包含一个“非常有趣的”3S螺环:“自然界还产生了其他几种化学物质,它们具有类似的螺心安多药效团。然而,我们变得非常好奇,其中一些含有3R螺环辛醇环,与柠檬酸苷中的3S相反。
她说:“所有负责表达这种小分子的基因都聚集在这些真菌中,因此首先我们发现了基因簇,并分别研究了每个基因,以确定哪一个基因对催化特定的化学转化最为重要。”
一旦我们找到了它,我们就可以把这个基因从真菌中取出,放回一个用户友好的宿主。然后利用蛋白质纯化技术在试管中分离并测试其功能通过在真菌之外做任何事情,我们可以确定只有一种酶能完成这一功能。”
改良大肠杆菌大量表达CtdE蛋白。当随后用于化学转化时,CtdE催化了所需的3S立体选择性。她说:“我们的目标是了解这种酶如何控制这种特殊的3S立体化学的机制。”
Gao说,生物信息学分析、X射线晶体学和实验证实CtdE是催化3S立体选择性的唯一原因(另一种酶,phqK,已经被认为能催化3R手性。)“拥有一套能精确控制立体化学的两种酶将最终改善药物生产中的合成,”她说。
Gao指出,由于CtdE在室温下工作,它将有助于保持化学“绿色”希望这些生物催化剂能以更环保的方式催化化学反应。
原文检索:Structural basis of the stereoselective formation of the spirooxindole ring in the biosynthesis of citrinadins