Nat Commun | 趋化因子受体CCR5结构揭示配体识别和信号转导机制
2021-07-07 00:00:00
来源:网络整理
免疫细胞的定向迁移是人体发生和完成免疫应答的必要条件。趋化因子及其受体系统控制细胞的定向迁移,在病原体的感染与清除、炎症反应、细胞及器官的发育、创伤的修复、肿瘤的形成及转移、移植免疫排斥等方面发挥着重要作用,是目前治疗各类炎症、艾滋病和癌症等疾病的热门靶点。针对趋化因子受体开展结构和功能研究可为相关药物开发提供基础和依据。 趋化因子受体CCR5与多种免疫相关炎症性疾病(如多发性硬化症、风湿性关节炎、动脉粥样硬化、移植排斥和自身免疫性疾病等)、癌症及病原体感染密切相关,但CCR5的细胞信号识别与转导机制尚未被明确阐明。 近日,中国科学院上海药物研究所吴蓓丽课题组、赵强课题组和许叶春课题组联合运用单颗粒冷冻电镜技术、X射线晶体衍射法以及动态构象计算模拟等方法,结合功能实验对CCR5的配体识别及信号转导机制进行了系统的研究:成功解析了CCR5分别与两种内源性配体(MIp-1α与RANTES)及G蛋白的复合物电镜结构,以及CCR5在不结合配体状态下与G蛋白的复合物电镜结构,同时还解析了CCR5与MIp-1α的高分辨率晶体结构。研究首次全面系统地阐释了CCR5对内源性配体的识别机制和对细胞信号的转导机制,以及组成性激活状态下的受体激活机制。北京时间2021年7月6日,相关论文以“Structural basis for chemokine recognition and receptor activation of chemokine receptor CCR5”为题发表于国际学术期刊Nature Communications。这也是吴蓓丽课题组继2013年在Science上发表CCR5与抗艾滋病药物maraviroc的复合物结构后在趋化因子受体方面又一研究成果。 以往研究表明,趋化因子受体的N端区域对内源性趋化因子的识别发挥重要作用,但已报道的趋化因子受体结构中均不包含完整的受体N端。此次,研究人员通过解析CCR5与MIp-1α的复合物高分辨率晶体结构,并结合二硫键交联、分子动力学模拟,首次阐明了CCR5的N端与趋化因子的精细作用模式,为深入理解趋化因子的特异性识别机制提供了重要信息。 通过比较CCR5分别与两种不同趋化因子结合的复合物结构,研究人员发现,与结合MIp-1α的受体相比,CCR5与RANTES结合后其第一和第二个跨膜螺旋向外偏移,配体结合口袋开口增大,从而容纳体积较大的RANTES的N端,这一发现提示CCR5跨膜螺旋构象的可塑性为其结合不同的趋化因子提供了结构基础。 与之前解析的CCR5处于非激活态的结构相比,MIp-1α和RANTES的N端插入到受体的跨膜螺旋口袋中,通过与受体氨基酸Y251的形成氢键作用,将受体中的关键氨基酸W248的构象稳定在激活状态。此外,研究人员还发现CCR5不结合配体时,受体第二个跨膜螺旋上氨基酸W86的侧链翻转90度,并进一步通过与Y108、Y251、W248等形成疏水相互作用将受体稳定在激活构象,从而促使受体与G蛋白结合。这是首次阐明趋化因子受体的组成性激活机制。 该研究系统地揭示了CCR5在生理状态下与不同内源性趋化因子的识别模式,阐明了该受体对趋化因子信号转导的分子机制,为深入理解趋化因子受体的配体识别与信号转导机制提供了重要的结构信息,并为后续开展靶向药物的研发打下了坚实的基础。 本研究的第一作者包括上海药物所博士研究生张慧、陈坤,副研究员谭秋香、韩硕,研究员邵强。上海药物所研究员吴蓓丽、赵强、许叶春和博士后朱亚为共同通讯作者。该研究获得了国家自然科学基金、国家重点研发计划、中国科学院战略性先导科技专项、国家博士后创新人才支持计划和博士后基金的资助。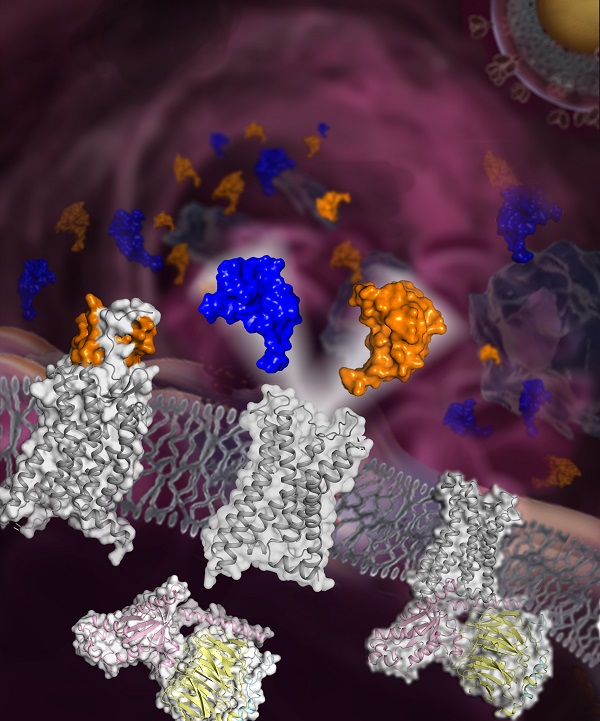

图片:趋化因子受体CCR5结构示意图。CCR5在多种免疫相关炎症性疾病及癌症中发挥重要作用,是治疗艾滋病和免疫性疾病的热门靶点。图下方灰色飘带表示CCR5,图中蓝色和橙色的表面图表示与CCR5结合的两种内源性配体MIp-1α和RANTES,G蛋白的三个亚基分别用粉色、黄色和青色表示。(图片由中国科学院上海药物研究所吴蓓丽课题组提供)
全文链接:https://www.nature.com/articles/s41467-021-24438-5
(供稿人:吴蓓丽;供稿部门:吴蓓丽课题组)





























