中山大学eLife发文:艾滋病病毒潜伏感染新发现
在国家自然科学基金项目(批准号:32070159)等资助下,中山大学邓凯课题组报道了一个新颖的可在CD4+ T细胞中模拟HIV-1潜伏感染的细胞模型,为进一步阐明病毒储存库细胞的特征和维持机制提供了重要的研究工具。该研究成果以“一种新设计的HIV-1双荧光报告病毒的感染能够有效鉴定潜伏感染的CD4+ T细胞”(Infection with a newly designed dual fluorescent reporter HIV-1 effectively identifies latently infected CD4+ T cells)为题,于2021年4月09日在线发表于《eLife》。论文链接:https://elifesciences.org/articles/63810。
艾滋病由HIV-1(人类免疫缺陷病毒1型)感染引起,是一种在全球范围内造成广泛危害的人类传染病,我国近年来HIV-1感染者人数呈较快趋势增长,形势不容乐观。因此,加强艾滋病防治的基础研究非常重要。尽管联合抗病毒治疗(俗称鸡尾酒疗法)能有效抑制病毒复制,使HIV-1感染者可以长期带毒生存,但由于病毒可在记忆性CD4+ T细胞中潜伏感染形成稳定的病毒储存库,艾滋病至今仍无法治愈。患者一旦停药,储存库就会释放新的活病毒,导致感染卷土重来。由于HIV-1在所潜伏的CD4+ T细胞中处于沉默状态,不进行复制也不产生病毒抗原,因而在表型上与正常CD4+ T细胞没有明显区别,这为研究潜伏感染细胞的特征造成极大的困难。该研究建立了一种新颖的可直接观察HIV-1潜伏感染的细胞模型,从该模型中获得的HIV-1潜伏感染细胞具有高度的生理相关性。同时,利用类似的策略在Jurkat细胞系上也成功构造出一类含有整合位点多样性的细胞系模型(J-mC)。基于J-mC细胞,通过高通量药物筛选鉴定了一个新的小分子化合物ACY-1215,可作为HIV-1潜伏的逆转药物,为艾滋病功能性治愈的临床方案提供了新的选择(图1)。
该工作针对HIV-1潜伏感染细胞缺乏标志物,难以识别的研究瓶颈,建构了一个新颖的可体外特异性标记潜伏感染原代CD4+ T细胞的模式HIV-1工具。基于此工具,首次建立了一类含有多样性病毒整合位点的潜伏感染细胞系模型,为进一步阐明HIV-1潜伏储存库的特征,及其建立与维持的分子机制提供了新的研究思路,具有重要应用前景。
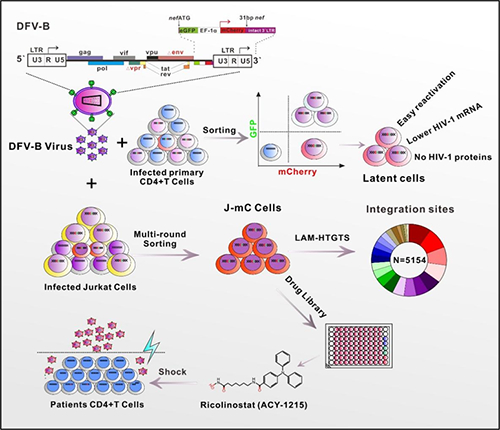
图1 HIV-1潜伏感染细胞的生成与其特点概要图






























