唐宏课题组发现提高抗体应答率和疫苗保护性的新机制
这次新冠大流行,使得人们再次认识到疫苗是预防感染和控制疫情传播的最佳手段。然而,不管哪条技术路线开发的疫苗,接种人群后往往达不到100%保护。影响疫苗保护率的因素很多,除了人种因素、个体因素外,还主要跟疫苗的形式有关。上世纪八十年代以来,重组病毒样颗粒疫苗(例如乙肝疫苗、HpV疫苗)因其超然的安全性、强劲的免疫原性和优异的保护率,成为疫苗技术的领跑者。然而,这类蛋白颗粒疫苗也有不尽人意的地方,例如,有5-10%乙肝疫苗接种者抗体水平达不到免疫保护的效价(统称疫苗不应答者)。这些不应答人群即成为感染乙肝病毒的高危人群,严重阻碍了人类最终消灭乙肝的进程。

针对这个棘手的难题,中科院上海巴斯德研究所唐宏课题组的博士生林欣文和李舒然和博士后Trix Twelkmeyer在《美国科学院院报》(pNAS)2021年x月xx日在线发表了题为Homeostatic regulation of T follicular helper and antibody response to particle antigens by IL-1Ra of medullary sinus macrophage origin的论文,提供了关键的答案。
该研究发现乙肝疫苗等颗粒抗原,特异性地诱导淋巴结中一种巨噬细胞,髓窦巨噬细胞(medullary sinus macrophages,MSM),产生的一种叫白介素-1受体拮抗因子(IL-1Ra)的细胞因子,是抑制B细胞产生高水平抗体的“罪魁祸首”。颗粒疫苗其直径跟病毒类似,进入体内后会进入一种叫引流淋巴结的器官,在这里首先接触到淋巴结的被膜下淋巴窦巨噬细胞(SCS),然后向MSM扩散。进一步研究发现,在乙肝疫苗激活MSM细胞产生的诸多调节免疫反应的细胞因子中,IL-1Ra能产生高水平表达。IL-1Ra具有抑制B囊泡中的T细胞(Tfh)刺激B细胞成熟和产生抗体的能力(又叫引流淋巴结的生发中心反应)。因此,把这群巨噬细胞剔除,或把IL-1Ra基因从巨噬细胞中敲除后,乙肝疫苗的抗体应答显著升高。类似的,小鼠注射IL-1Ra的阻断性抗体后,再免疫乙肝疫苗,不仅提高抗体滴度,更能显著地保护小鼠清除乙肝病毒的攻毒感染。因为MSM在淋巴结中负责过滤和清除血液流入的大颗粒外源物质,所以不光是乙肝疫苗,甲肝疫苗等灭活疫苗的抗体应答也受IL-1Ra的调节。
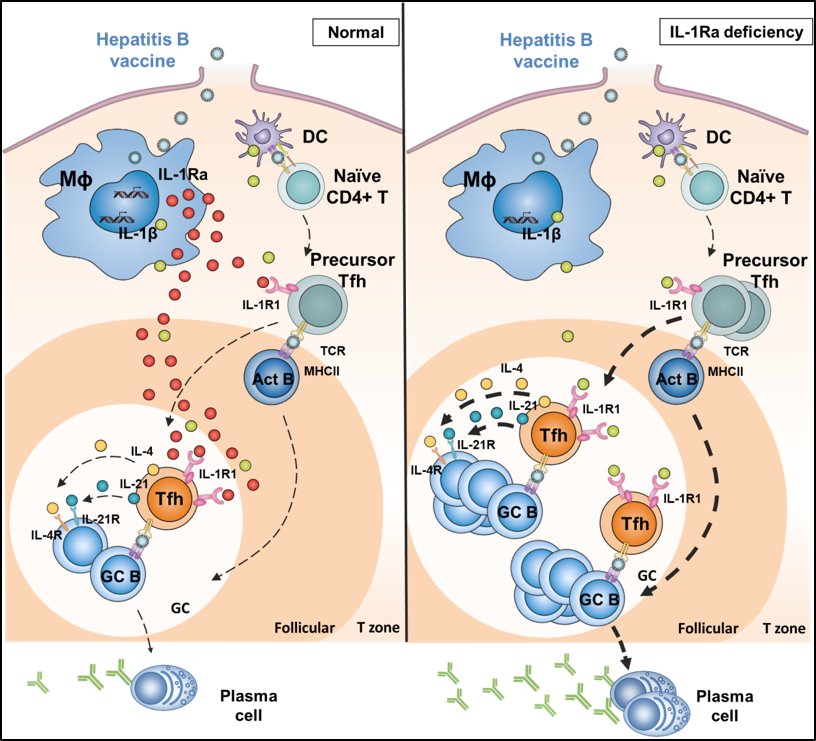
HBV疫苗进入引流淋巴结后诱导巨噬细胞产生高水平IL-1ra从而抑制Tfh细胞活化和抗体生成。
研究人员进一步地分析了乙肝疫苗应答和不应答人群的血清。发现不应答者血清中IL-1Ra的浓度显著高于应答者,并与乙肝抗体滴度有显著的负相关性。因此,低水平的IL-1Ra可能是疫苗有效保护性的一个重要指标。更进一步,研究人员根据在小鼠转录组实验中发现的可以控制巨噬细胞表达IL-1Ra的基因,按图索骥,对不同地域和人种的乙肝疫苗应答数据库进行了深入分析,发现调节IL-1Ra基因表达的增强子元件存在7个重要的多型性突变(SNp),虽然分析显示它们与乙肝疫苗的抗体不应答没有相关性。但值得注意的是,其中一个突变位点(rs4251982)是非洲地区人群特有的,而相比其他各地区人口,非洲人群对HBV疫苗的应答率最低。
这些重要发现表明,引流淋巴结中的特定巨噬细胞通过产生的IL-1Ra细胞因子来调节Tfh/B细胞的抗体应答水平。IL-1Ra因子水平高低可能作为一种新型的乙肝疫苗不应答人群的诊断指标,也可为提高乙肝疫苗等颗粒疫苗免疫原性和保护性提供全新的疫苗佐剂的开发依据。
该工作由中国科学院上海巴斯德研究所、中国科学院北京生物物理研究所侯百东课题组和广州市妇女儿童医疗中心龚四堂课题组合作完成。上海巴斯德研究所唐宏研究员,北京生物物理研究所侯百东研究员及李舒然为论文的共同通讯作者,上海巴斯德研究所唐宏组博士生林欣文与广州市妇女儿童医疗中心博士后Trix Twelkmeyer为该论文的共同第一作者。研究得到科技部、国家自然科学基金委和中科院的经费支持。
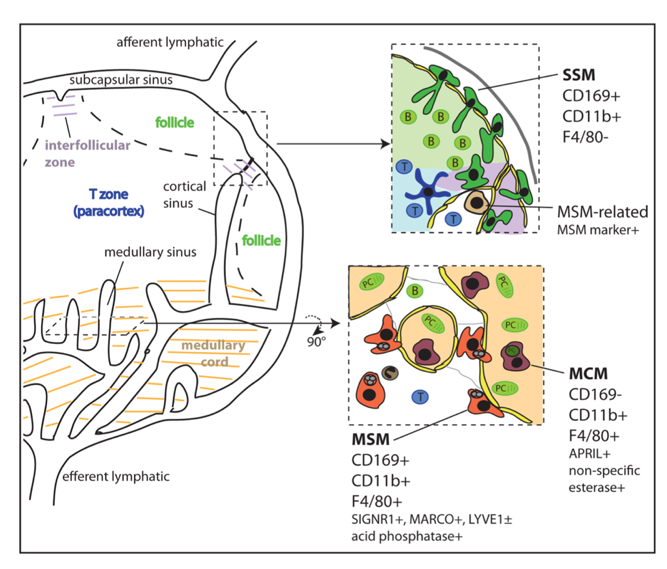
引用自Elizabeth EG et al. J Innate Immun. 2012。淋巴结巨噬细胞的分布,包括边缘窦巨噬细胞SCS和髓窦巨噬细胞MSM。SCS/SSM:Subcapsular sinus macrophage,MSM : Medullary sinus macrophage
文章链接:https://www.pnas.org/content/118/17/e2019798118






























