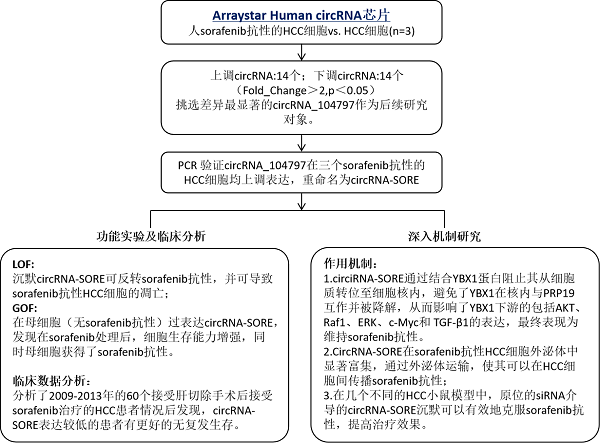
circRNA-SORE 在肝癌 sorafenib 耐药中的重要作用和机制
近期,浙江大学医学院附属邵逸夫医院蔡秀军教授团队在肝癌耐药领域发表了题为《CircRNA-SORE mediates sorafenib resistance in hepatocellular carcinoma by stabilizing YBX1》 的研究性论文,阐述了circRNA参与的晚期肝癌一线靶向治疗药Sorafenib(索拉非尼)的耐药机制。
作者利用Arraystar circRNA芯片筛选得到一个在sorafenib抗性肝细胞癌(HCC)细胞中上调表达的circRNA-SORE,该circRNA在肝细胞癌的sorafenib抗性中发挥重要作用,敲除circRNA SORE能显著提升sorafenib的细胞杀伤力。进一步的研究证明,circRNA- SORE在胞质中与核心原癌蛋白YBX1结合,阻止了YBX1进入核内与E3泛素连接酶pRp19的结合,从而抑制了pRp19介导的YBX1蛋白的降解。同时,体外及体内的实验还发现,circRNA- SORE可以通过外泌体运输在HCC细胞中传播sorafenib抗性。作用利用不同的HCC小鼠模型证明,通过siRNA沉默circRNA-SORE可以充分地克服sorafenib抗性。总体而言,作者的研究为通过靶向circRNA-SORE或YBX1来克服sorafenib抗性的肝癌治疗提供了潜在的策略。该研究成果刊登在Nature旗下的学术期刊Signal Transduction and Targeted Therapy(IF:13.493)上。(芯片实验由康成生物丨数谱生物提供技术服务)
研究背景
肝细胞癌(HCC)是一种最常见的且是在全球发病率不断增长的肿瘤。sorafenib(索拉非尼)是第一个FDA认证的用于晚期HCC的靶向治疗药物。早前的研究表明,sorafenib将不符合肝移植或肝切除资格的晚期HCC患者的中位总生存期(OS)延长了2.3-3个月。然而很多HCC患者对sorafenib反应差,或者经过几个月的治疗就产生了sorafenib抗性(或sorafenib耐药)。HCC的sorafenib抗性通常在治疗后的6个月内会产生。证据表明,在HCC中,原发性和获得性的sorafenib耐药或抗性涉及多种机制,仍待充分研究。
CircRNA是一类内源的非编码RNA,在真核转录组中呈现组织和阶段特异性表达。与线性非编码RNA相比,circRNA因为封闭的环状结构而更加稳定。越来越多的证据表明,circRNA在多种癌症相关过程如肿瘤发生、进展、复发及耐药性(或药物抗性)中发挥作用。常见的作用机制有:CircRNA直接结合miRNA,充当miRNA吸附海绵或与蛋白相互作用来发挥功能。
外泌体(Exosomes)是一类细胞外囊泡,在多种生理及病理过程中发挥重要作用。近期的研究发现,肿瘤来源的外泌体可能在很多恶性肿瘤如HCC中作为药物抗性的传播者而发挥功能。此外,在一些癌症的外泌体中,circRNA是富集的,因此可以作为一种基于外泌体的肿瘤生物标志物。然而,外泌体转运的circRNA是否以及如何在癌症,尤其是在HCC中发挥作用仍需要深入研究。
技术路线
文章结果
CircRNA-SORE在sorafenib抗性HCC细胞中高表达
作者成功构建了3个sorafenib抗性的HCC细胞系:HepG2-SR、LM3-SR和 SKhep1-SR,挑选了sorafenib抗性与母细胞表现差异最大的HepG2-SR细胞进行Arraystar circRNA芯片实验,从中鉴定出14个显著上调和14个显著下调表达的circRNA(fc>2,p<0.05)。在这14个显著上调的circRNA中,circRNA_104797的变化最显著。qpCR在3个细胞系中均验证了circRNA_104797的上调表达。因此作者将其命名为circRNA-SORE (a circular RNA upregulated in sorafenib-resistant HCC cells)。
图释:左:Arraystar circRNA芯片筛选得到的差异最显著的上下调共28个circRNA聚类展示;
右上:Arraystar circRNA芯片散点图;右下:Arraystar circRNA芯片火山图。
作者进一步发现,circRNA-SORE是TLE基因的两个外显子反向拼接形成的环状RNA。为了验证circRNA-SORE是否含有共价封闭的环状结构,作者先后使用了放线菌素D处理、RNase R处理及non-polyA tail RNA样本来检测circRNA-SORE,证明了circRNA-SORE封闭结构。
CircRNA-SORE对维持sorafenib抗性很关键
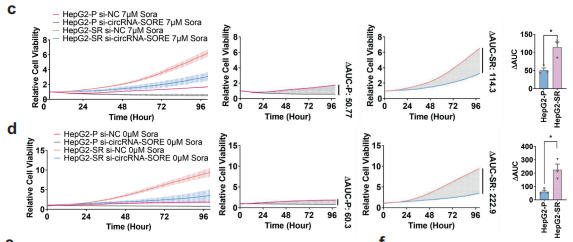
作者检测了沉默circRNA-SORE在sorafenib抗性细胞中的作用,结果表明敲低circRNA-SORE能显著反转sorafenib抗性并可以显著抑制sorafenib抗性HCC细胞的生长,但对母细胞影响甚微(下图c&d)。同时,实验还发现沉默circRNA-SORE可导致sorafenib抗性HCC细胞的凋亡。作者通过 pLCDH-ciR-SORE在母细胞(无sorafenib抗性)中过表达circRNA-SORE,发现在sorafenib处理后,细胞生存能力增强,同时还发现母细胞获得了sorafenib抗性。以上结果表明了circRNA-SORE在HCC sorafenib抗性中的关键作用,同时表明沉默circRNA-SORE能显著提高sorafenib诱导的细胞凋亡。
紧接着,作者为了检测了CircRNA-SORE是否可以作为 sorafenib药物疗效预测的生物标志物,分析了2009-2013年的60个接受肝切除手术后接受 sorafenib治疗的HCC患者情况后发现,circRNA-SORE表达较低的患者有更好的无复发生存。该结果提示了使用circRNA-SORE作为预测 sorafenib药物疗效的生物标志物的潜能。
CircRNA-SORE通过与YBX1蛋白结合发挥作用
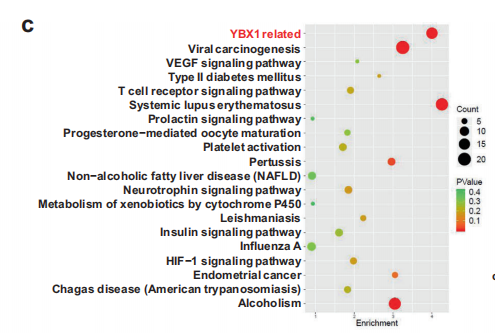
在探究circRNA-SORE在维持sorafenib抗性中的作用机制时,作者先通过实验排除了circRNA-SORE通过调控它的host gene TLE 4 mRNA或蛋白的表达来介导sorafenib抗性的假设,随后把研究重点放到circRNA和蛋白互作上。作者分别用LC-MS/MS实验分析了circRNA-SORE pull-Down和敲低circRNA-SORE细胞中的蛋白,共鉴定到10个交集蛋白,这些交集蛋白就是既能和circRNA-SOR结合,同时又受circRNA-SORE调控的蛋白。这其中有一个核酸结合蛋白YBX1,在circRNA-SORE序列中有该蛋白的的结合序列(CCAAT)。受circRNA-SORE调控蛋白的KEGG分析也显著富集在一个与YBX1相关的信号通路(见下图)。
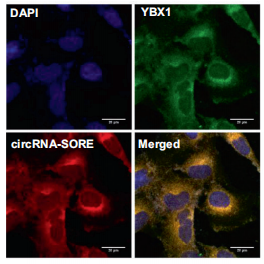
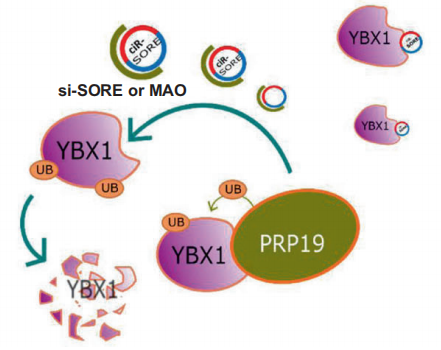
作者又通过靶向circRNA-SORE 结合序列Y-BOX(CCAAT)的MAO序列封闭结合位点处理后的细胞、突变circRNA-SORE结合序列Y-BOX(CCAAT)处理后细胞与对照细胞的 circRNA-SORE pull-Down和YBX1-RIp实验相互交叉证实circRNA-SORE的确是通过Y-BOX序列(CCAAT)与YBX1结合。同时,circRNA-SORE与YBX1的免疫荧光定位实验也表明两者主要共定位在细胞浆中(下图)。
为了进一步研究YBX1的功能,作者从TCGA数据库中分析了肝组织和正常组织的RNAseq结果,发现在HCC组织中YBX1高表达。同时,与YBX1表达水平低的HCC患者比较,YBX1表达水平高的患者总生存期更短。
在三个sorafenib抗性HCC细胞中敲低YBX1,sorafenib抗性减弱,细胞凋亡增加,细胞形态也受到影响。沉默circRNA-SORE的sorafenib抗性细胞中YBX1蛋白表达降低,YBX1下游的靶基因如AKT、 Raf1、 ERK、 c-Myc和TGF-β1,而在过表达YBX1后,这种影响可以被回复。过表达circRNA-SORE对sorafenib抗性的影响也会被沉默YBX1削弱。综合所有结果,可以证明,circRNA-SORE介导的sorafenib抗性是通过结合YBX1蛋白实现的。
CircRNA-SORE通过阻止pRp19介导的YBX1泛素化和降解稳定YBX1的表达
沉默CircRNA-SORE会导致YBX1 mRNA水平上升,而YBX1蛋白水平下降,说明其中不涉及转录调控。作者通过放线菌酮追踪检测发现,沉默circRNA-SORE会导致YBX1蛋白稳定性下降,而用蛋白酶体抑制剂MG132处理后,YBX1蛋白水平上升。这些结果表明circRNA-SORE是通过阻止YBX1的降解来稳定YBX1蛋白。随后作者发现,circRNA-SORE是通过结合YBX1影响YBX1的泛素化及降解。
作者通过蛋白质谱最终锁定了参与了YBX1泛素化的酶——pRp19 。siRNA沉默pRp19的HepG2-SR细胞中YBX1泛素化水平降低、蛋白水平升高,同时还可以回复敲低circRNA-SORE导致的YBX1降低。该结果表明,pRp19介导的YBX1泛素化和降解参与了circRNA-SORE-YBX1调控。定位实验中,再次确认circRNA-SORE主要分布在细胞质中,而敲低circRNA-SORE后,部分YBX1从细胞质转位至细胞核中。而有报道指出pRp19主要定位在细胞核内,因此该结果意味着,circiRNA-SORE通过结合YBX1阻止其从细胞质转位至细胞核内,而避免了YBX1在核内与pRp19互作并被降解(见下图)。
CircRNA-SORE可以通过外泌体运输传播sorafenib抗性
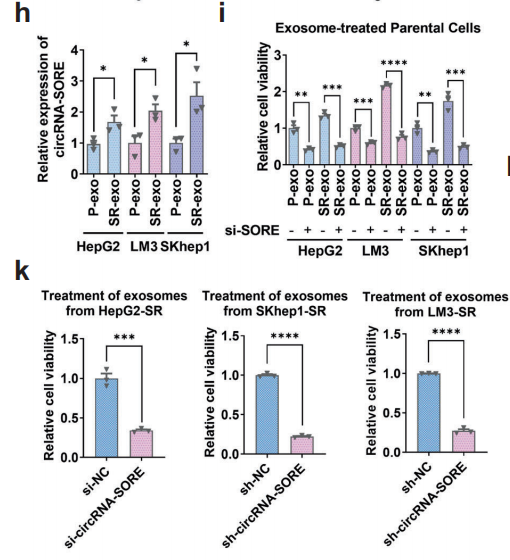
有报道指出circRNA可以在外泌体中富集,也有报道指出,抗药性可以通过外泌体传播。作者通过qRT-pCR 检测了从HepG2-SR细胞及其母细胞HepG2-p培养液中分离出的外泌体中circRNA-SORE的表达,发现有sorafenib 抗性的HepG2-SR细胞培养液的外泌体中有更多的circRNA-SORE富集。此外,sorafenib 抗性细胞培养液比细胞胞浆内有更显著的circRNA-SORE表达。将上述两类外泌体分别与HCC细胞共培养,发现接受了来源于sorafenib 抗性细胞培养液外泌体的HCC细胞中有更高的circRNA-SORE表达(下图h),也对sorafenib有更强的抗性(下图i)。这个结果意味着外泌体在传播circRNA-SORE 介导的sorafenib抗药性中扮演重要角色。同时作者还发现,接受了circRNA-SORE沉默的sorafenib抗性细胞来源的外泌体的HCC细胞与对照组相比对sorafenib更敏感(下图k)。为了进一步研究外泌体的作用,作者构建了HCC细胞的裸鼠移植瘤模型,并对裸鼠进行了4周的sorafenib治疗。紧接着,从sorafenib抗性HCC细胞和母细胞培养液中获取的外泌体分别注射入移植瘤位点。经过4周,观察肿瘤大小发现,接受了sorafenib抗性HCC细胞培养液外泌体的小鼠肿瘤更大。这表明,这些小鼠从外泌体中获得了药物抗性。以上结果表明,外泌体在传播circRNA-SORE介导的sorafenib抗性中发挥关键作用。
体内实验证明,充分地沉默circRNA-SORE可以提高sorafenib的药物疗效
为了进一步确定了体内circRNA-SORE介导的sorafenib抗性中的重要作用,作者使用了三种不同的模型:
1.原位sorafenib抗性细胞系来源的小鼠移植瘤模型
2.皮下sorafenib抗性细胞系来源的小鼠移植瘤模型
3.sorafenib抗性患者来源的小鼠移植瘤模型
在第一种小鼠模型下,移植了circRNA-SORE敲低的sorafenib抗性HCC细胞的小鼠比移植了对照sorafenib抗性HCC细胞小鼠对sorafenib处理更敏感。在第二种小鼠模型下,相比于在移植位点注射对照siRNA,注射si-circRNA-SORE能显著提高小鼠对sorafenib的敏感性。在第三种小鼠模型下,也有同第二种模型相类似的结果。
综合以上结果表明,剥夺circRNA-SORE可以提高三个小鼠HCC模型对sorafenib的敏感性。也支持了通过沉默circRNA-SORE提高HCC患者的sorafenib药物疗效的临床潜能。
文章总结
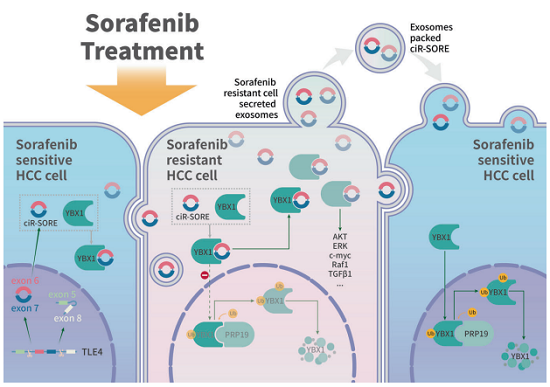
作者的研究发现了一个circRNA-SORE,在维持和传播HCC的sorafenib抗性中发挥重要作用。
1.circiRNA-SORE通过结合YBX1阻止其从细胞质转位至细胞核内,而避免了YBX1在核内与pRp19互作并被降解,从而影响了YBX1下游的包括AKT、 Raf1、ERK、c-Myc和TGF-β1的表达;
2.CircRNA-SORE通过外泌体运输,使其可以在HCC细胞间传播sorafenib抗性;
3.在几个不同的HCC小鼠模型中,原位的siRNA介导的circRNA-SORE沉默可以有效地克服sorafenib抗性,提高治疗效果。
综合以上,作者的研究提供了一个潜在的临床应用,即使用siRNA-circRNA-SORE 联合sorafenib用于晚期肝细胞癌(HCC)患者的治疗。
原文链接
CircRNA-SORE mediates sorafenib resistance in hepatocellular carcinoma by stabilizing YBX1
康成生物丨数谱生物可提供的相关技术服务
CircRNA 表达研究技术平台:
▪CircRNA表达谱检测——Arraystar circRNA芯片:
针对CircRNA反向剪接位点设计特异性探针,准确检测circRNA,比测序更适合于circRNA表达谱分析。助力客户发表SCI文章超过350篇;
▪circRNA qRT-pCR:
技术成熟,circRNA反向剪接位点设计引物,特异性检测目标circRNA。
▪circRNA与蛋白互作(circRNA ChIRp-MS)
CircRNA可作为蛋白海绵或者蛋白结合的骨架,影响蛋白功能。 circRNA ChIRp-MS通过用biotin标记的RNA anti-sense与已交联的样本进行杂交,并通过固定化avidin对biotin进行pull-Down,得到RNA结合蛋白(RBp)并通过质谱鉴定目标circRNA结合的蛋白。
外泌体组学:
外泌体分离、外泌体鉴定、外泌体转录组学及外泌体蛋白组学等
更多circRNA研究技术平台:
▪circRNA m6A检测——Arraystar circRNA表观转录组芯片:
检测发生m6A修饰的circRNA;定量修饰百分比及修饰变化;total RNA要求量低至3ug。
▪circRNA m6A 甲基化pCR检测:
(1)验证或者检测某个m6A 修饰的circRNA:m6A抗体富集发生m6A修饰的circRNA + circRNA反向剪接位点设计引物保证m6A-circRNA的精确检测
(2) 确定含有潜在m6ACA位点的circRNA是否真实发生m6A修饰:RNase R去线性RNA+ MazF酶处理 + m6ACA位点pCR检测 。