郎靖瑜研究组揭示胸苷酸合成酶抑制剂药物敏感性预测标志物
2019年10月21日,中国科学院上海营养与健康研究所郎靖瑜研究组在国际学术期刊EBioMedicine在线发表了研究论文“MYC predetermines the sensitivity of gastrointestinal cancer to antifolate drugs through regulating TYMS transcription”。该研究揭示了癌基因MYC对胸苷酸合成酶(Thymidylate synthase, TYMS)的转录调控作用,为化疗药物胸苷酸合成酶抑制剂的临床精准化应用提供了新线索。
胸苷酸合成酶是传统抗肿瘤药物研发最重要的药靶之一。作为体内唯一负责从头合成胸腺嘧啶脱氧核苷一磷酸(Thymine deoxynucleoside monophosphate, dTMp)的限速酶,胸苷酸合成酶以亚甲基四氢叶酸为底物将尿嘧啶脱氧核苷一磷酸(Uracil deoxynucleoside monophosphate, dUMp)甲基化为dTMp,亚甲基四氢叶酸则转化为二氢叶酸,而dTMp可进一步磷酸化为DNA合成和修复重要原料之一的胸腺嘧啶脱氧核苷三磷酸(Thymine deoxynucleoside triphosphate, dTTp)。根据竞争性结合底物不同,TYMS抑制剂可分为嘧啶类似物和叶酸类似物两大类。以5-氟尿嘧啶(5FU)为代表的嘧啶类似物主要通过竞争性结合dUMp从而抑制胸苷酸合成酶活性,而以雷替曲塞(Raltitrexed, RTX)、氨甲蝶呤(Methotrexate, MTX)、和培美曲塞(pemetrexed, pTX)为代表的叶酸类似物主要通过竞争性结合四氢叶酸从而抑制胸苷酸合成酶活性。从上个世纪五六十年代开始,TYMS抑制剂就广泛应用于白血病、胃肠道肿瘤和非小细胞性肺癌等疾病治疗但其临床治疗效果却不尽如人意。以胃癌和结肠癌为例,全世界每年新发病例近280万,但其中仅10-20%患者对5FU为主的化疗方案具有良好的响应率。
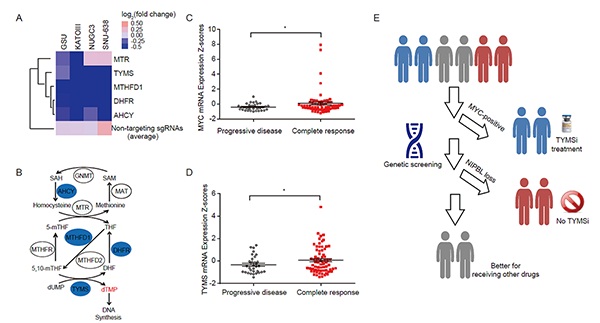
以博士研究生刘婷婷、韩玉民和俞春红为主的研究团队通过CRISpR/-Cas9全基因组敲除方法筛选并鉴定出了调控胃肠道肿瘤细胞对TYMS抑制剂药物敏感性的关键分子癌基因MYC,同时分析TCGA数据发现MYC在胃癌和结肠癌患者中分别存在13.2%和6.4%基因扩增比例。进一步机制研究表明,MYC主要通过结合TYMS基因启动子从而调控其转录活性。同时,研究团队还发现Cohesin复合物调控因子NIpBL在胃癌和结肠癌患者中分别存在10.2%和6.4%基因突变,并且主要以移码突变等失活形式为主。此外,进一步实验结果显示,NIpBL失活通过降低MYC转录活性从而抑制TYMS基因表达,使得胃肠道肿瘤对TYMS抑制剂药物敏感性丧失。最后,通过分析TCGA胃肠道肿瘤患者用药数据,研究团队发现MYC和TYMS高表达肿瘤患者对TYMS抑制剂具有更好的临床响应率,为TYMS抑制剂临床精准化应用提供了新线索。
中国科学院上海营养与健康研究所郎靖瑜研究员为论文的通讯作者,课题组的博士研究生刘婷婷、韩玉民和俞春红为论文的共同第一作者。本研究获得了国家科技部、国家自然科学基金委、上海市科委和中国科学院的项目资助以及中国科学院上海营养与健康研究所公共技术平台的支持。
图1. MYC高表达胃肠道肿瘤对胸苷酸合成酶抑制剂具有较好的响应率。(A)全基因组敲除筛选结果表明一碳循环代谢通路成员对维持胃肠道肿瘤细胞存活具有关键作用;(B)一碳循环代谢通路模式图,蓝色为筛选结果阳性基因;(C-D) TCGA胃癌患者临床用药数据显示MYC和TYMS mRNA高表达肿瘤患者对TYMS抑制剂具有更显著的临床响应率;(E) TYMS抑制剂临床精准化用药模式假想图。
原文链接:https://doi.org/10.1016/j.ebiom.2019.10.003