中大学者Nature子刊发文:脑胶质母细胞瘤作用机制新发现
脑胶质瘤是中枢神经系统(CNS)常见的恶性肿瘤,其中过半数是WHO IV级的胶质母细胞瘤。手术、化疗、放疗是目前恶性胶质瘤传统治疗方法。由于大多数恶性胶质瘤呈浸润性生长,与正常组织无明显分界,所以单靠手术无法根治。术后一般都辅以放、化疗,但因为放射剂量限制及放疗抗拒,其临床效果不佳。对于化疗,尽管替莫唑胺的出现被称为近40年来脑胶质瘤化疗的最大进步,但其整体治疗效果仍不理想。因此恶性胶质瘤的预后极差,成人恶性胶质母细胞瘤规范化治疗后的中位生存期仅14.2个月。最近去世的美国参议院议员约翰-麦凯恩也是因为胶质母细胞瘤,从2017年7月确诊到今年8月去世,总生存期也只有13个月。
对于胶质母细胞瘤,在抗血管生成和靶向治疗领域,目前仅有贝伐单抗(抗血管内皮生长因子(VEGF)抗体)在2009年被美国FDA批准用于复发的胶质母细胞瘤,但是在2014年2月,在新英格兰杂志同时发表了两项研究贝伐单抗在新诊断胶质母细胞瘤一线治疗的III期临床研究,包括MD安德森癌症中心主导的RTOG 0825和法国艾克斯-马赛大学附属医院主导的NCT00943826临床研究,都发现贝伐单抗对新诊断胶质母细胞瘤患者只能延长3个月左右的pFS,中位pFS从7个月延长到10个月,而未能延长总生存期(中位生存期仅16个月左右)。
胶质母细胞瘤的血管生成异常丰富,对于胶质母细胞瘤的抗血管内皮生长因子治疗抵抗或者疗效不佳,其中必定存在某种机制。
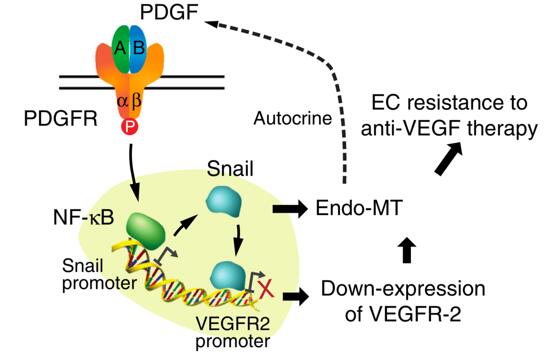
从2015年开始,中山大学附属肿瘤医院的牟永告教授团队、张振峰教授团队与宾夕法尼亚大学的Fan Yi教授团队合作研究胶质母细胞瘤抗血管内皮生长因子治疗抵抗的研究,他们发现在胶质母细胞瘤微环境中存在的肿瘤相关血管内皮细胞有明显的间质化的趋势,而间质化的血管内皮细胞主动下调了血管内皮生长因子受体-2(VEGFR-2)的表达,但同时又利用血小板源性生长因子受体激活后下游的信号通路来维持自己的间质化以及血管生成的能力,利用药物联合靶向血小板源性生长因子受体(VEGFR)和血小板源性生长因子受体(pDGFR)在小鼠原发胶质母细胞瘤模型上能够有效杀伤肿瘤并延长生存期,这项研究提示了联合靶向VEGFR和pDGFR的抗血管生成治疗有治疗胶质母细胞瘤的巨大潜力。
近期这一研究组又发表了题为“pDGF-mediated mesenchymal transformation renders endothelial resistance to anti-VEGF treatment in glioblastoma”的文章,发现血小板源性生长因子介导的间充质转化致使胶质母细胞瘤血管内皮细胞对抗血管内皮生长因子治疗抵抗,揭示了胶质母细胞瘤内肿瘤相关血管内皮细胞通过血小板源性生长因子相关机制促进自身的内皮-间质转化以及诱导抗血管内皮生长因子治疗抵抗的具体分子机制,进一步揭示了联合靶向血小板源性生长因子受体和血管内皮生长因子受体的抗血管生成治疗在胶质母细胞瘤中的应用前景。
脑胶质母细胞瘤内的血小板源性生长因子促进了肿瘤内血管内皮细胞从上皮样细胞向间充质样细胞的转变,促使了肿瘤对抗血管内皮生长因子治疗抵抗
这一研究成果公布在Nature Communications杂志上。
这项研究提示胶质母细胞瘤的抗血管内皮生长因子治疗疗效不佳的原因是因为治疗靶点上的缺陷,而不是抗血管生成治疗方向的问题,提示进一步开展相关的临床研究将有希望产生激动人心的胶质母细胞瘤治疗效果。基于这项合作研究的结果,团队有望开发新一代的抗血管治疗方案、用于包括胶质母细胞瘤在内的多种实体肿瘤临床治疗。原文标题:
pDGF-mediated mesenchymal transformation renders endothelial resistance to anti-VEGF treatment in glioblastoma