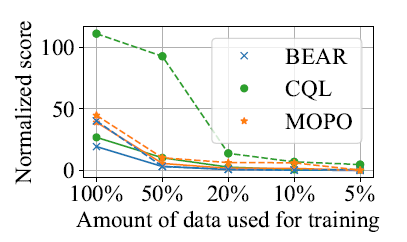
李勤喜团队揭示GLS1聚集成杆状结构促进谷氨酰胺饥饿诱导的细胞凋...
2022年4月4日,我室李勤喜课教授课题组在Molecular Cell杂志在线发表了题为Filamentous GLS1 promotes ROS-induced apoptosis upon glutamine deprivation via insufficient asparagine synthesis的研究论文。该研究首次报道了谷氨酰胺缺乏能够诱导谷氨酰胺酶(GLS1)形成杆状多聚体进而促进细胞凋亡的机理。

谷氨酰胺是非常重要的能源物质,也是生物合成中碳源和氮源的重要提供者,多种肿瘤细胞的生长和增殖高度依赖于谷氨酰胺代谢。GLS1是谷氨酰胺分解的第一个酶和限速酶,能催化谷氨酰胺水解为一分子谷氨酸和一分子氨离子。大量研究表明GLS1在小细胞肺癌、肝癌、结直肠癌等多种肿瘤中高表达。目前,已经开发了若干种GLS1的特异性抑制剂用于科学研究和临床前期研究,其中CB839被证明对非小细胞肺癌、三阴性乳腺癌的增殖有一定的抑制效果,但其并不能促进细胞死亡。且大量临床实验表明CB839的疗效仅限于控制肿瘤的发展,而非导致其消退。有研究表明谷氨酰胺饥饿会引起细胞凋亡,且在实体瘤中存在谷氨酰胺饥饿现象,但这种凋亡与GLS1有无关系?其具体的分子机理是什么?目前尚不甚清楚。因此,鉴定在谷氨酰胺饥饿状态下促发细胞凋亡的起始信号,阐明信号传递的具体分子机理有可能为开发新的抗肿瘤策略提供思路。
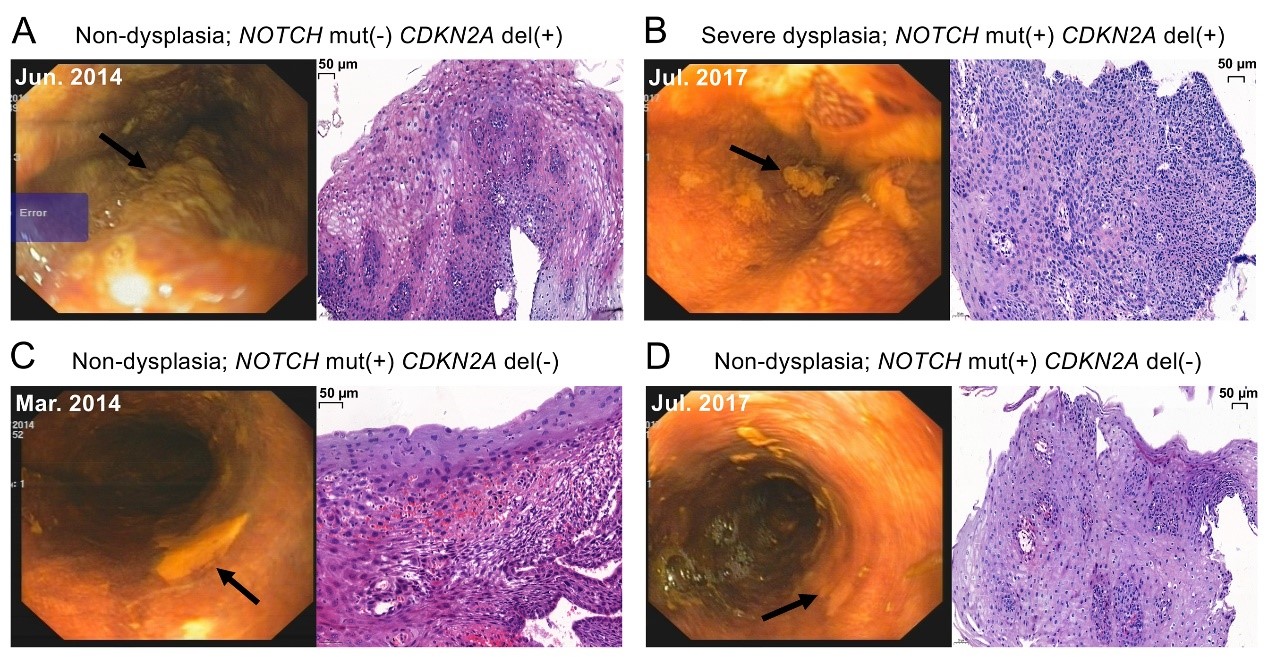
李勤喜课题组研究人员发现在多个细胞系中敲除GLS1能显著抑制由谷氨酰胺饥饿诱导的细胞凋亡。有意思地是,通过免疫荧光染色,他们发现GLS1在谷氨酰胺饥饿状态下,聚集成微米级别的杆状结构。当在细胞内表达无法形成杆状结构的GLS1 K507E突变体时,饥饿诱导的细胞凋亡明显被抑制。而过表达自发形成杆状结构的GLS1 K320A突变体则加速了谷氨酰胺饥饿诱导的细胞凋亡(图1)。
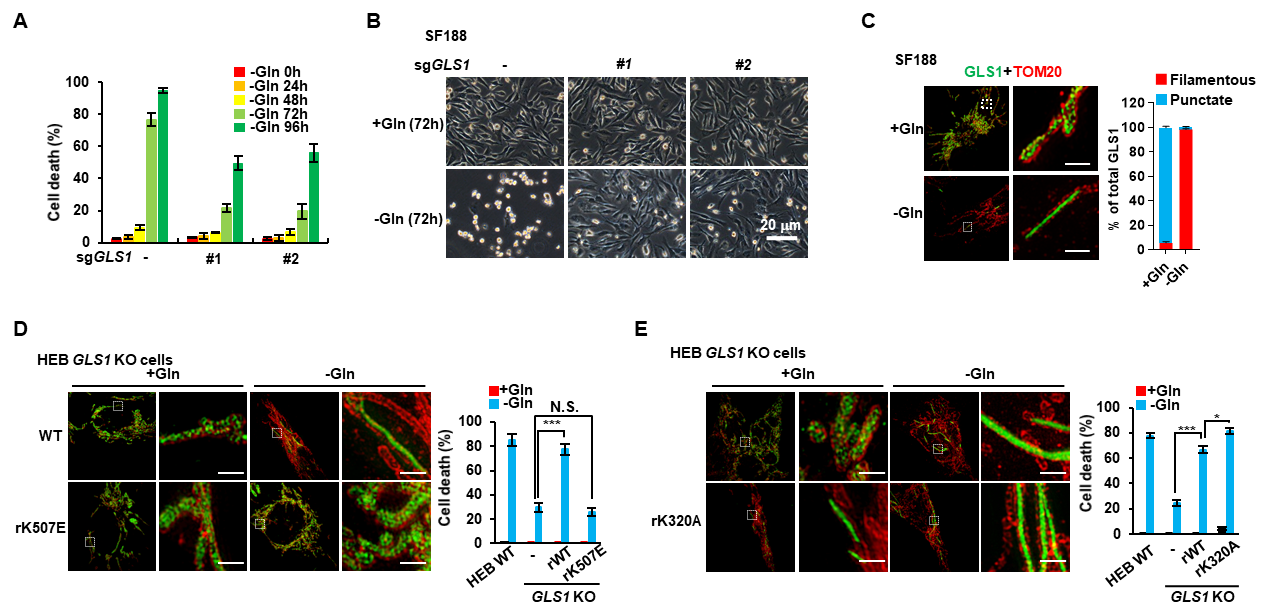
图1.谷氨酰胺饥饿诱导GLS1形成杆状复合物并促进细胞凋亡
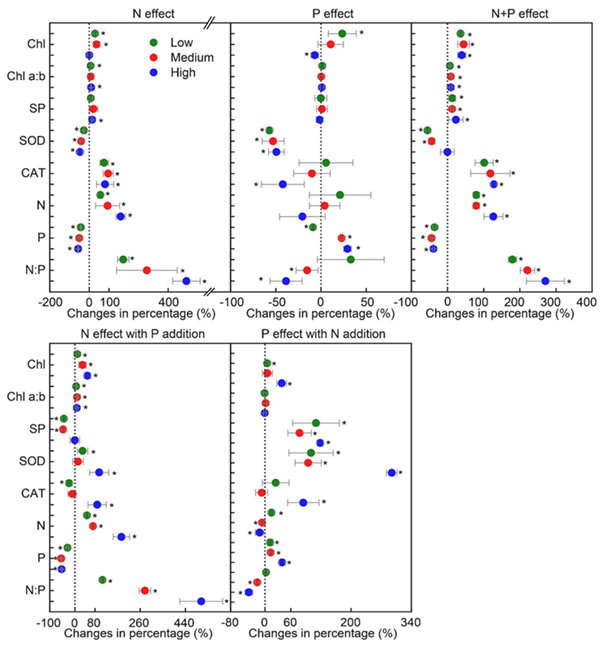
进一步研究表明谷氨酸是细胞内GLS1形成杆状结构的负调控因子。细胞处于谷氨酰胺饥饿状态时,谷氨酰胺衍生出来的谷氨酸浓度下降。当谷氨酸浓度低于一定阈值时,失去了对GLS1的抑制作用,此时GLS1由二聚体形式聚合成微米级别的杆状结构。细胞实验和体外酶活实验表明,杆状结构的形成极大地促进了GLS1与其底物谷氨酰胺的亲和力和催化活性。机理研究表明,高度活化的GLS1杆状多聚物能够进一步将细胞内本已稀少的谷氨酰胺转化为谷氨酸,造成谷氨酰胺的耗竭。在此情况下,依赖于谷氨酰胺的天冬酰胺的合成亦被抑制,进而引起线粒体基因组编码的蛋白合成受限、线粒体呼吸链的复合体被破坏,最终导致ROS的大量累积和细胞凋亡(图2)。
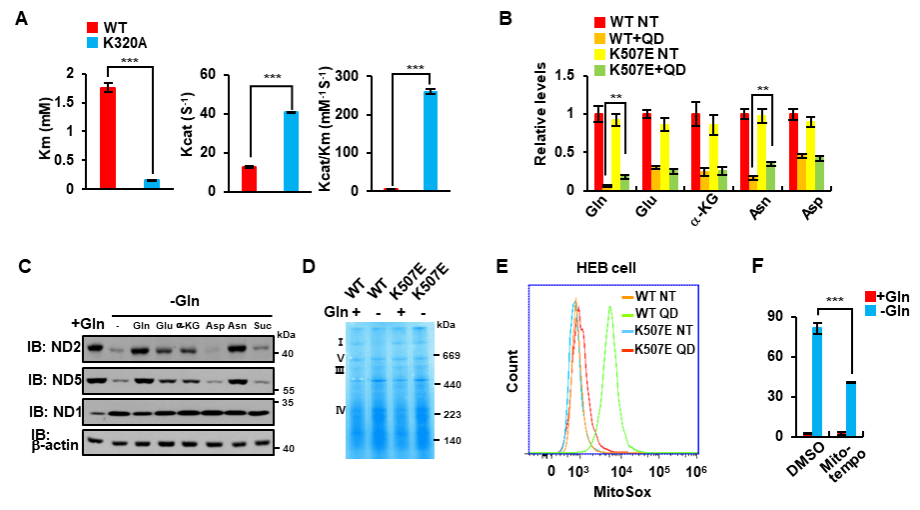
图2. GLS1形成杆状结构阻断天冬酰胺的合成并诱导ROS依赖的细胞凋亡
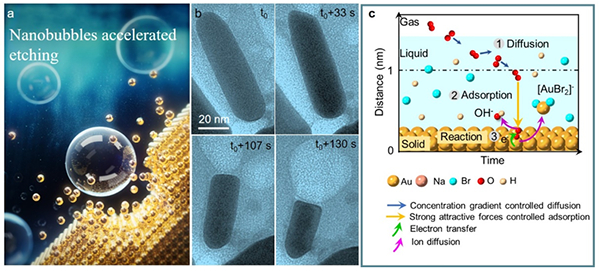
在临床胃癌和胰腺癌的样本的核心位置,大量GLS1以杆状结构的形式存在。更重要的是,在肿瘤细胞中稳定表达能自发形成杆状结构的突变体(GLS1 K320、GLS1 S482C)显著抑制了癌细胞的增殖和体内移植瘤的生长(图3),表明操纵GLS1杆状多聚体的形成可能是一种新兴的癌症治疗策略。
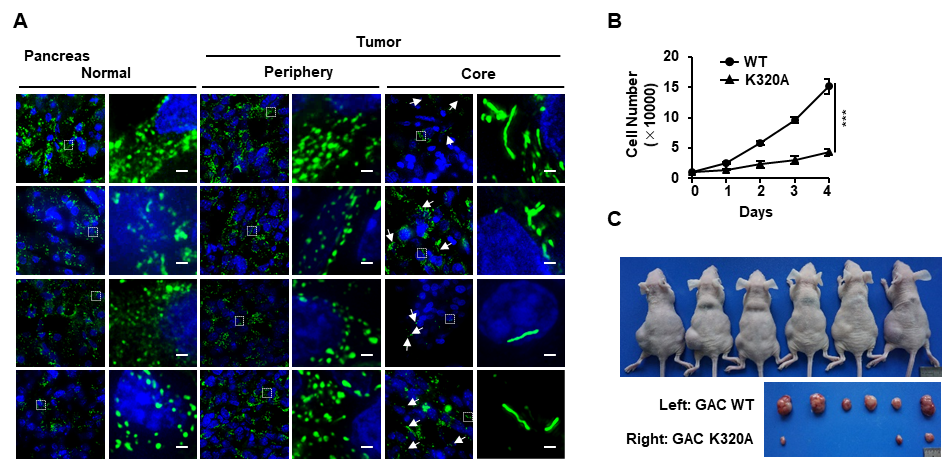
图3.操纵GLS1杆状结构的形成能抑制肿瘤的进程
综上,该研究揭示了GLS1通过感应其产物浓度进行结构重塑,进而启动细胞凋亡的分子机理(图4),同时为谷氨酰胺依赖性肿瘤的治疗提供了新的视角。

图4. GLS1聚合成杆状结构促进谷氨酰胺饥饿诱导的细胞凋亡的机理
李勤喜教授为论文通讯作者,江彬助理教授、张佳助理教授和博士研究生赵国辉为论文的共同第一作者。该工作得到了国家自然科学基金、中央高校基本科研业务费专项资金和厦门大学细胞应激生物学国家重点实验室开放研究基金等的支持。该研究得到了我室张宸崧教授、韩爱东教授和化学化工学院林东海教授的大力支持。厦门大学生物医学仪器共享平台的章赐雄博士、吴彩明博士、姚路明博士和刘庆锋博士为该项目的研究提供了重要的技术支持。
原文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(22)00254-4
Bioart链接:https://mp.weixin.qq.com/s/yQc7SojKBe-xgIhSBBCtJw
MEM公众号链接:https://mp.weixin.qq.com/s/Hjhum8gbW7q1CQQ_vehIOA
(图/文李勤喜课题组)






![[学院新闻] 拟南芥高质量参考基因组Col-PEK发布](http://meetings.ebiotrade.com/public/curlnews/20220609/2022060906535762a128858ca56.png)