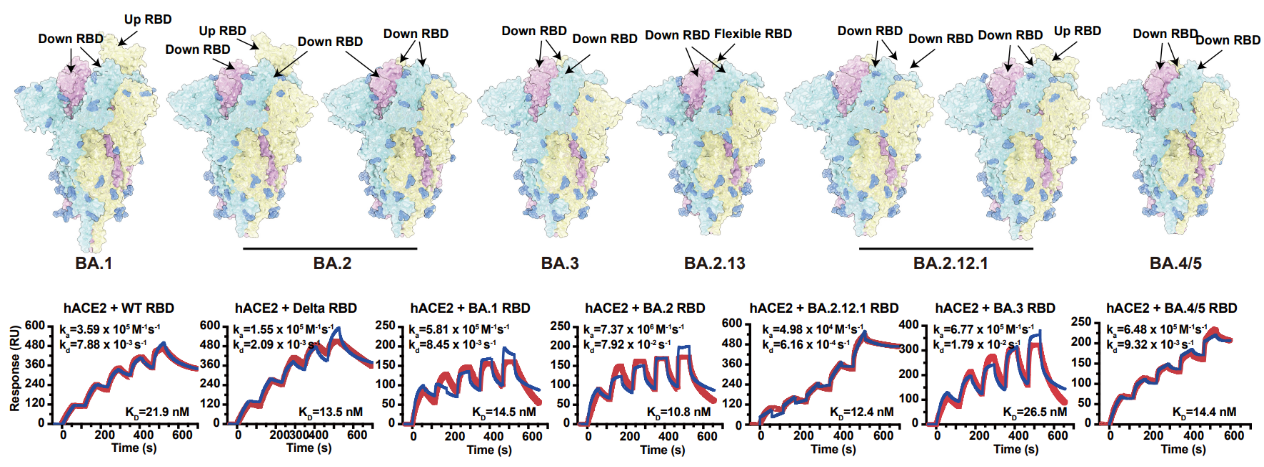
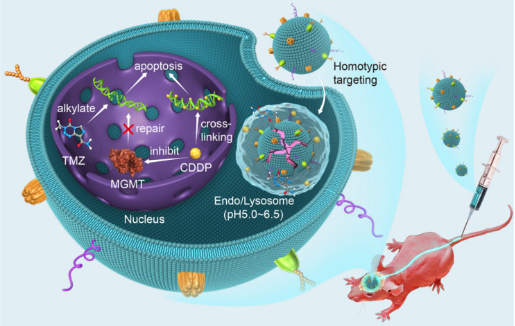
耐药乳腺癌具有附属敏感性拮抗剂研究新进展
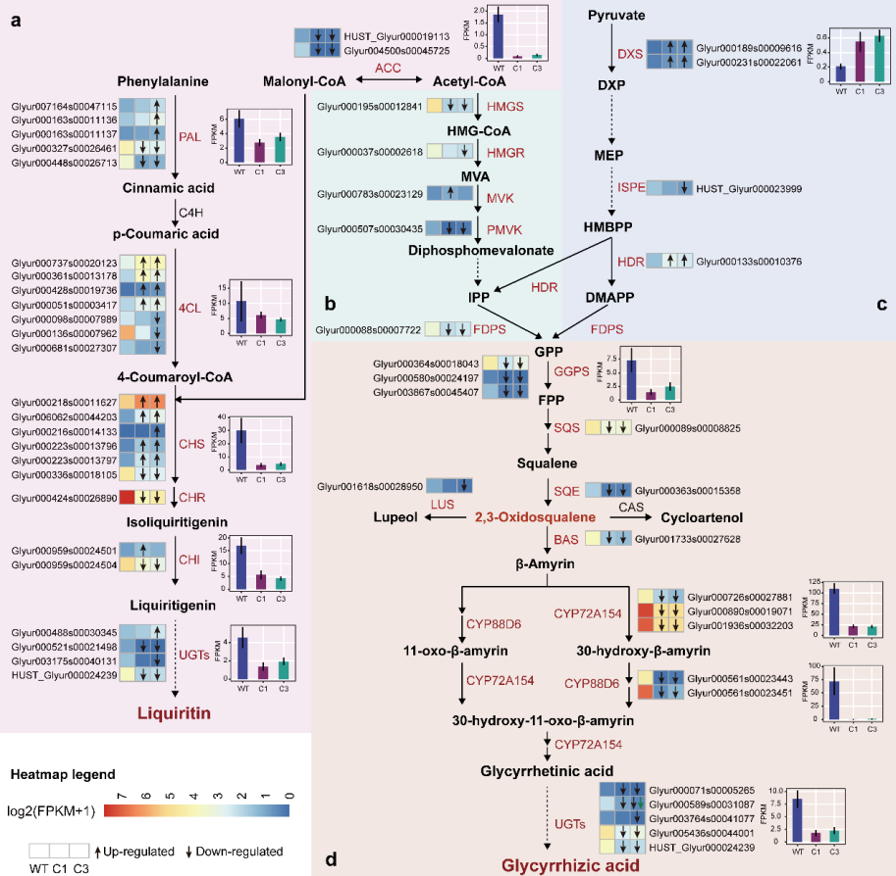
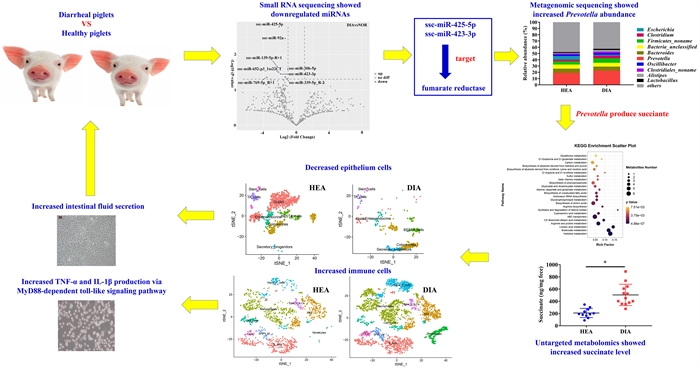
近日,复旦大学药学院药物化学系陈瑛教授课题组与药理学系刘洪瑞副教授课题组合作,在药物化学领域权威期刊《Journal of Medicinal Chemistry》上发表了题为“Novel Hybrids of 3-Substituted Coumarin and phenylsulfonylfuroxan as potent Antitumor Agents with Collateral Sensitivity against MCF-7/ADR”的研究论文。构建了一类呋咱-香豆素偶联的NO供体型化合物,对p-gp过表达阿霉素耐药的乳腺癌展示了显著的附属敏感性。
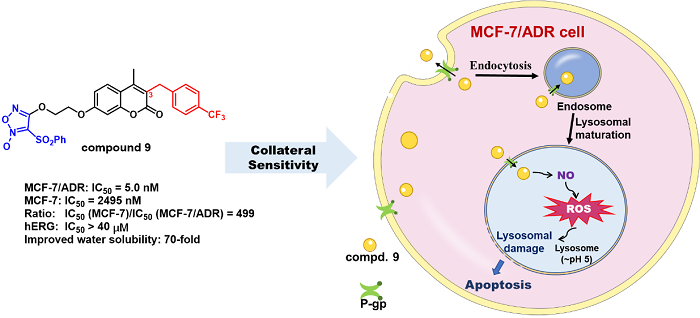
咱-香豆素偶联物9的化学结构、活性及药理机制
2020年乳腺癌发病率在癌症中达到全球第一,耐药形成也是乳腺癌药物治疗中的难题。近年来,靶向溶酶体抗肿瘤的研究也逐渐受到广泛关注,溶酶体膜上具有来源于细胞膜的p-gp。据报道,p-gp在耐药乳腺癌中表达高达58.9%。设计可利用耐药乳腺癌病理状态下过表达的p-gp的化合物,进入溶酶体增加膜透性和膜损伤,诱导细胞凋亡,达到抗耐药肿瘤的思路,或是一种研发治疗耐药乳腺癌等多药耐药肿瘤药物的新策略。
本论文基于前期研究发现对p-gp过表达耐药乳腺癌具有显著附属敏感性的苗头化合物,进一步结构优化,获得呋咱-香豆素偶联的新NO供体型先导化合物9。其对p-gp过表达耐阿霉素乳腺癌(MCF-7/ADR)抑制的EC50达到5 nM,抑制活性比对敏感型乳腺癌(MCF-7)高499倍,即对耐药乳腺癌瘤株具有更高的附属敏感性。研究还发现,化合物9可以进入MCF-7/ADR细胞的溶酶体内,释放有效浓度的NO,并产生活性氧(ROS),增加溶酶体膜透性,释放溶酶体内的标志性蛋白酶Cathepsin D,诱导细胞凋亡。化合物9对MCF-7/ADR的附属敏感性表现,在于其具有可利用耐药肿瘤过表达的p-gp进入溶酶体释放NO以及活性氧形成的特点。此外,化合物9对非瘤乳腺上皮细胞株MCF-10A以及健康小鼠均未见显著性毒性;且溶解度也比苗头化合物提高70倍。
综上,此类呋咱-香豆素偶联的化合物,兼具p-gp底物和胞内赋能释放NO并形成ROS的内在特性,达到高选择性抑制耐药乳腺癌的目的。同时,因此类化合物利用耐药肿瘤过表达的p-gp进入溶酶体而非抑制其功能的优势,可避免产生如p-gp抑制剂缺乏组织选择性导致的毒副作用,显示较优秀的安全性和成药潜力。这将为发现治疗p-gp过表达耐药乳腺癌新药,满足临床需求提供新的研究基础。
复旦大学药学院药物化学系2018级硕士生于智慧、2016级硕士生王可;药理学系2020级硕士生李梦茹为本文的共同第一作者;药物化学系陈瑛教授和药理学系刘洪瑞副教授为本文的共同通讯作者。相关研究工作得到了上海市科委项目、国家科技重大专项等的资助。
原文链接:https://doi.org/10.1021/acs.jmedchem.2c00608