Cell:线粒体基因组编辑的新时代已经开启
从1968年第一个限制性内切酶的发现,1985年聚合酶链式反应(pCR)的发明,到2013年crispr介导的基因组编辑技术的展示,每一个生物技术的新突破都进一步提高了我们操纵DNA这一生命蓝图的能力。特别是,最近开发的CRISpR-Cas系统,即“基因剪刀”,可以对活细胞进行全面的基因组编辑。这为通过编辑我们基因组中的突变来治疗以前无法治愈的基因疾病开辟了新的可能性。
然而,尽管基因编辑在细胞的核基因组方面取得了很大的成功,但科学家们在编辑线粒体方面一直没有成功,线粒体也有自己的基因组。线粒体,所谓的“细胞发电站”,是细胞内的微小细胞器,是能量产生工厂。由于它是能量代谢的重要细胞器,如果该基因发生突变,就会引起严重的与能量代谢相关的遗传疾病。
“由于线粒体DNA的缺陷,出现了一些非常严重的遗传病。例如,Leber遗传性视神经病变(LHON)会导致双眼突然失明,它是由线粒体DNA的一个简单的单点突变引起的。”另一种线粒体基因相关疾病包括伴有乳酸酸中毒的线粒体脑肌病和脑卒中样发作(MELAS),后者会慢慢破坏患者的大脑。一些研究甚至表明,线粒体DNA的异常也可能是阿尔茨海默病和肌肉萎缩等退行性疾病的原因。
线粒体基因组是从母系遗传来的。已知线粒体DNA中有90种致病点突变,每5000人中至少有1人会发生这种突变。许多现有的基因组编辑工具由于传递到线粒体的方法的局限性而无法使用。例如,CRISpR-Cas平台并不适用于编辑线粒体中的这些突变,因为引导RNA不能进入细胞器本身。
“另一个问题是,缺乏这些线粒体疾病的动物模型。这是因为目前还无法制造出动物模型所需的线粒体突变。”“缺乏动物模型使得开发和测试这些疾病的治疗方法非常困难。”
因此,编辑线粒体DNA的可靠技术是基因组工程的最后前沿之一,为了征服所有已知的遗传疾病,必须探索它,世界上最精英的科学家多年来一直努力使之成为现实。
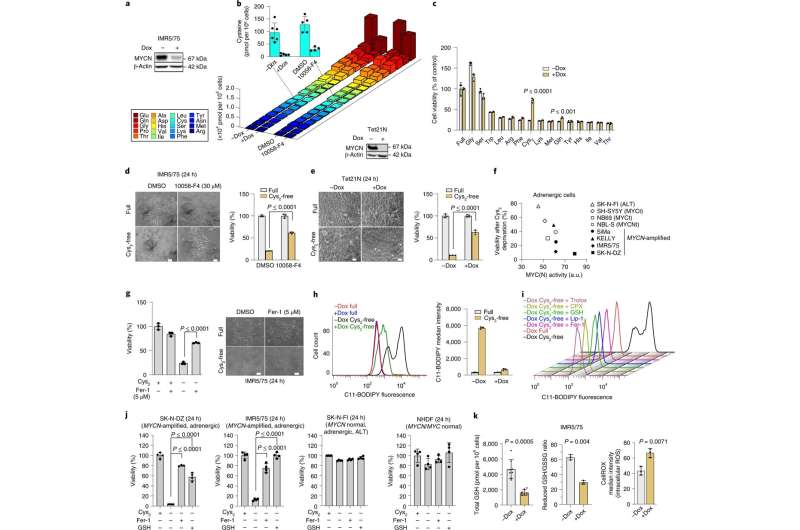
2020年,哈佛大学布罗德研究所和麻省理工学院的David R. LIU领导的研究人员创建了一种新的碱基编辑器,名为ddda衍生的胞嘧啶碱基编辑器(DdCBEs),可以实现线粒体DNA的C-to-T转换。这是因为创造了一种新的基因编辑技术,称为碱基编辑,它可以在不破坏DNA的情况下将一个核苷酸碱基转换为另一个。然而,这种技术也有其局限性。它不仅局限于c -t转换,而且主要局限于TC基序,使其成为有效的TC- tt转换器。这意味着它只能纠正90个已证实的致病线粒体点突变中的9个(= 10%)。在很长一段时间里,线粒体DNA从a到g的转换被认为是不可能的。
作者表示:“我们开始思考克服这些局限性的方法。因此,我们能够创建一个新的基因编辑平台,称为TALED,可以实现a到g转换。我们新的碱基编辑器极大地扩展了线粒体基因组编辑的范围。这不仅对疾病模型的制作,而且对治疗方法的开发也有很大的贡献。”值得注意的是,仅在人类mtDNA中进行A-to-G转换,就可以纠正90种已知致病突变中的39种(= 43%)。
研究人员通过融合三种不同的组件创造了TALED。第一个组成部分是一个转录激活子样效应器(TALE),它能够靶向DNA序列。第二种成分是TadA8e,一种促进a - g转化的腺嘌呤脱氨酶。第三种成分DddAtox是一种胞嘧啶脱氨酶,使DNA更容易接近TadA8e。
TALED的一个有趣的方面是TadA8e在具有双链DNA (dsDNA)的线粒体中执行A-to-G编辑的能力。这是一种神秘的现象,因为已知TadA8e是一种只针对单链DNA的蛋白质。金所长表示:“TadA8e只适用于单链DNA,利用它对线粒体进行碱基编辑的想法从未出现过。正是这种跳出框框的思维方式帮助我们发明了TALED。”
研究人员推测,DddAtox可以通过瞬时解开双链来接近dsDNA。这个短暂但短暂的时间窗口允许TadA8e,一种超快速作用的酶,快速地进行必要的编辑。除了调整TALED的组成部分,研究人员还开发了一种技术,可以同时进行a -to- g和C-to-T碱基编辑,也可以只进行a -to- g碱基编辑。
该团队通过创建含有所需mtDNA编辑的单细胞克隆,展示了这项新技术。此外,TALEDs既不具有细胞毒性,也不引起mtDNA的不稳定性。核DNA无不良脱靶编辑,mtDNA无脱靶效应。研究人员现在的目标是通过提高编辑效率和特异性进一步改善TALEDs,最终为纠正胚胎、胎儿、新生儿或成年患者的致病mtDNA突变铺平道路。该团队还致力于开发适用于编码植物光合作用必需基因的叶绿体DNA的A-to-G碱基编辑的TALEDs。
Journal Reference:
Sung-Ik Cho, Seonghyun Lee, Young Geun Mok, Kayeong Lim, Jaesuk Lee, Ji Min Lee, Eugene Chung, Jin-Soo Kim. Targeted A-to-G base editing in human mitochondrial DNA with programmable deaminases. Cell, 2022; DOI: 10.1016/j.cell.2022.03.039