《Nature Immunology》奇怪的DNA结构
拉霍亚免疫学研究所(LJI)的科学家发现了TET酶的缺失是如何导致B细胞淋巴瘤的。他们的研究发表在《Nature Immunology》杂志上,可能为设计针对许多癌症中的恶性细胞的药物治疗策略提供机会。
这项新研究由LJI癌症免疫治疗中心的Anjana Rao博士领导,实验由LJI导师Vipul Shukla博士(即将成为西北大学的助理教授)和加州大学圣地亚哥分校研究生Daniela Samaniego-Castruita领导。
这项新的研究帮助科学家们最终将癌细胞中的两种危险现象联系起来。
在之前的研究中,科学家在许多血癌和实体癌患者身上发现了导致TET酶失去功能的突变。研究人员还发现,基因组的不稳定性,如DNA密码中的双链断裂,是癌细胞的共同特征
在这个项目中,科学家们探索了TET缺陷与基因组不稳定性有关的一种潜在途径。
“这项研究为该领域的一个重要问题提供了见解,”Shukla说。
通过对小鼠淋巴瘤模型的研究,研究人员发现,在成熟B细胞中删除TET2和TET3酶对B细胞稳态有巨大的影响。Samaniego-Castruita说:“缺乏TET的小鼠患上了淋巴瘤,我们观察到与基因组不稳定相关的标记增加,比如双链断裂。”
该团队随后进行了基因组分析,以寻找分子水平上发生的情况的线索。他们发现,在没有TET2和TET3的情况下,DNA变得充满了被称为G-四复体和R-环的不寻常DNA结构。
DNA通常有两条平行的链,就像梯子的两根栏杆。当由RNA构成的第三条轨道滑进DNA轨道,迫使两个DNA轨道之间产生一个缺口时,R-环就出现了。G-四聚体就像DNA轨道上的结。当细胞试图读取DNA密码并保持细胞正常工作时,G-四复体和R-环都使最初的两段DNA难以“解压缩”。
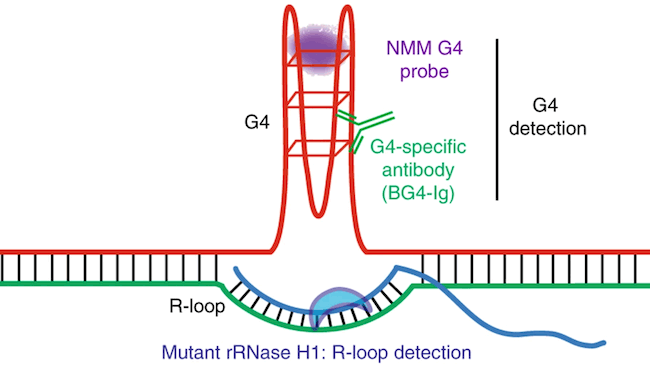
Shulka和Samaniego-Castruita在拉霍亚研究所的Tullie和Rickey家族免疫学创新奖的资助下,深入研究了这些DNA结构。Shulka说:“这些结构代表了DNA中比其他区域更脆弱的部位。通过这项研究,我们发现TET酶可能与这些结构的调控有关,这反过来可以解释在TET酶缺失的情况下获得基因组不稳定性的一种机制。”
当涉及到B细胞恶性肿瘤时,G-四聚体和R-环似乎是暴露TET突变和危险基因组不稳定性之间的缺失环节。
那么,如果G-四复体和R-环造成了问题,有没有办法阻止它们的形成呢?
Shukla和Samaniego-Castruita观察到,DNMT1在TET缺失的B细胞中上调。DNMT1是一种关键酶,负责维持DNA上被称为“DNA甲基化”的标记。DNA甲基化是基因组中一个重要的调控标记,通常通过TET酶的活性去除。
没有TET酶,DNA甲基化标记的正常交换和吸收被打破。因此,在他们的下一个实验中,科学家们也删除了小鼠的tet缺陷B细胞中的DNMT1基因,以测试在去除DNMT1蛋白后,G-四聚体和R-环的水平是否会改变。
事实上,DNMT1的删除显著延缓了侵袭性b细胞淋巴瘤的发展。Samaniego-Castruita说,DNMT1的删除也与G-四复体和R-环水平的降低有关。
研究人员强调,调节G-四复体和R-环可能只是TET酶控制基因组稳定性的一种方式。还有更多的工作要做,以揭示导致TET缺陷细胞在DNA中积累这些神秘结构的精确步骤。该团队希望有一天能够设计出策略,通过这种策略,G-四复体和R-环可以靶向帮助癌症患者。
随着Rao实验室继续研究TET酶的作用,Shukla将于今年冬天加入西北大学细胞与发育生物学系。他计划成立自己的实验室,专注于研究DNA中不同的结构构象。






























