厦门大学最新Nature发文:破解二甲双胍靶点
如果要我们列举几种自己所熟悉的药物,那么二甲双胍一定能占据一席之地。它不仅仅是治疗二型糖尿病的一线药物:便宜、降糖效果好且副作用小,更因为近年来不断发现的各种神奇功效:降低糖尿病人的体重、缓解脂肪肝,甚至于有潜在的抵抗由于糖尿病所引起的多种癌症的效果等,而被称为“明星”药物。特别地,对于健康人群,二甲双胍也很可能有抵抗衰老、延长寿命的作用。因此,它经常和卡路里限制一起,被列为人类未来通向健康长寿之路的重要手段之一。在国外,有数个大规模的探索二甲双胍对人类寿命影响的长期临床实验已经展开,目的就是要找到这一“健康密码”的最终证据,造福于我们的子孙后代。
然而,尽管二甲双胍有着如此耀眼的作用,它的分子靶点却一直没有弄清,这极大地限制了我们对二甲双胍的理解和应用——我们不知道二甲双胍的这些神奇效果是从何而来,由哪些分子所介导,当然也就没办法“举一反三”,去借助这些原理,设计相应策略来更好地行使这些功能。换句话说,我们还没有真正理解二甲双胍这一健康密码的本质。更何况,二甲双胍的作用是有局限性的,例如它只能作用于肝脏、肠道等少数几个组织,对于脂肪组织则无可奈何。因此,如果我们想使用二甲双胍,在减少脂肪的同时保留健硕的肌肉,而不是(因为吃得少)一起减少,那就是要尤其慎重的。如果能设计出专一性靶向脂肪组织里的二甲双胍靶点的药物,突破这一瓶颈,一定能为眼下日益严重的营养过剩等各种代谢性疾病的治疗带来福祉。
我室林圣彩院士团队正是在二甲双胍的分子靶点研究方面取得了突破。他们团队长期致力于代谢稳态和代谢疾病发生机制的研究,而从2014年起,他们就对二甲双胍产生了兴趣。那时人们已经发现,二甲双胍能够通过激活一个名为AMpK的蛋白行使上述的诸多功效,然而对于它如何激活AMpK,靶点又是什么,则完全没有弄明白:和二甲双胍相比,其它合成的AMpK激活剂并不具有二甲双胍的所有功效,而二甲双胍(超过临床剂量的除外)对于AMpK在体内的天然激活剂——AMp的水平提升也没有任何作用。种种迹象表明,二甲双胍对AMpK的激活可能是“另辟蹊径”的。经过探索,他们团队在2016年于Cell Metabolism上报道了二甲双胍可能通过他们先前发现的,机体感应饥饿和葡萄糖水平下降时所用的一条名为“溶酶体途径”的通路,激活AMpK的初步结论,为二甲双胍的功效行使指明了一个粗略的方向(关于这条中国人自己发现的新通路,详见林圣彩团队参与撰写的重要综述:『珍藏版』“Must-Read”综述丨阴阳相济的中庸之道——AMpK和mTORC1营养感知与细胞生长调节)。在上述基础上,他们又经过了五年多的探索,最终找到了二甲双胍的分子靶点——pEN2(γ-secretase的亚基),并搞清了它导向溶酶体途径,激活AMpK的具体方式,相关工作以Low-dose metformin targets the lysosome–AMpK pathway through pEN2为题于2022年2月24日发表在Nature杂志上。

在这一工作中,林圣彩团队首先通过与室内邓贤明团队合作,后者通过一系列摸索,突破了多个化学合成上的难题,合成了二甲双胍的化学探针。简单地说,这个探针的工作原理就像我们钓鱼一样,前端的“鱼钩”是二甲双胍这个分子,后端的“钓竿”则是一个名为生物素的标签:当前端的二甲双胍分子碰到了它所结合的蛋白,也就是靶点以后,我们就可以通过后端的标签,把二甲双胍连同它的靶点一起“钓”上来,再通过质谱等手段分析,就能知道二甲双胍结合的这个靶点是什么。通过这种方法,他们从细胞中“钓”出了2000多种可能和二甲双胍结合的蛋白。由于二甲双胍可以独立地通过溶酶体途径激活AMpK,他们于是从中筛选出了317种存在于溶酶体上的蛋白进行进一步验证。鉴于这些蛋白又很可能有不少是被“拔出萝卜带出泥”的,他们于是逐一验证了二甲双胍和这些蛋白的相互作用,又从中筛选到了113种,真正直接结合了二甲双胍的蛋白。之后,他们又逐一在细胞中敲低这些蛋白,最终找到了一个名为pEN2的蛋白,能够介导二甲双胍对AMpK的激活。后续的实验进一步表明,pEN2就是二甲双胍启动溶酶体途径激活AMpK的前提,而敲除了pEN2,二甲双胍不但不能激活AMpK,它对于降低脂肪肝、缓解高血糖、延长寿命等诸多效果就都不存在了。这些结果充分说明,二甲双胍确实通过pEN2激活AMpK,并起到各种功效,也就是说,pEN2就是二甲双胍的靶点。
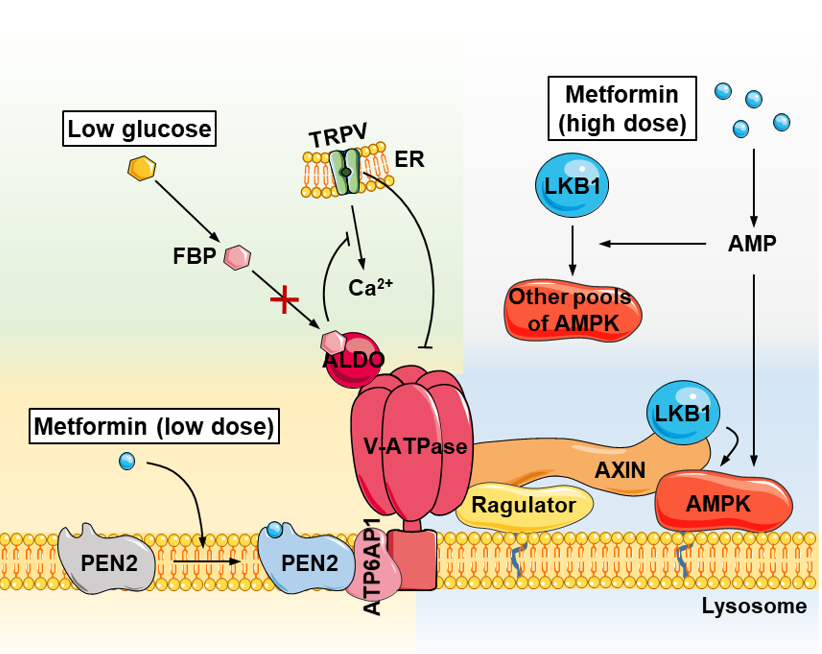
林圣彩团队的这一发现无疑加深了我们对二甲双胍这一“健康密码”的理解,不但首次从分子角度勾画出了二甲双胍行使功能的路线图,还为二甲双胍替代药品的筛选提供了潜在的靶点,从而在治疗糖尿病和其他代谢性疾病方面产生更好的疗效。有意思的是,尽管具体的分子靶点有些许不同,但二甲双胍和饥饿(葡萄糖水平下降)走的是同一条路线,即上述的溶酶体途径,可见大自然的大道至简。联想到卡路里限制可以看做是一种大尺度下的饥饿,而它和二甲双胍的功效又大有相似之处,这又让我们不得不喟叹长寿之路的万化归一,而我们祖先所推崇的辟谷养生是多么有前瞻性!当然,这一切的机制的解析的背后,离不开林圣彩团队长期以来的辛勤工作。实际上在目前,解析类似于二甲双胍这样的小分子和蛋白质的相互作用,仍是一个很前沿,或者说是很不成熟的领域。以他们此次发现二甲双胍的靶点的经历来看,事实上二甲双胍在水溶液中就像溶于其中的无数盐离子一样,而它所能结合的同样是水溶性的蛋白分子,就如同水中的各种盐离子一样,也是数不胜数。即使对于pEN2这个靶点本身,他们都发现了多个能结合二甲双胍的位点,这可能也是为什么他们课题组最后从2000多个潜在靶点中只找到了一个真正的靶点的原因。对于这种极高的“假阳性”,目前并没有任何手段加以避免,只能说是小分子和蛋白质结合的本质就是如此。因此,唯一的方法只能是不厌其烦地逐一筛选,而这需要的是热爱和执着,以及对小分子“见微知著”的坚定信念。

图解:长寿之道,殊途同归。辟谷的道士(暗示饥饿)和对面是炼丹炉(暗示二甲双胍)都是通过溶酶体-AMpK通路(上山的阶梯)达到营养的阴阳平衡最终长寿(丹顶鹤,仙人)。
该论文的共同第一作者为我室博士生马腾、田潇和张保锭,林圣彩教授、张宸崧教授、邓贤明教授为共同通讯作者。该工作得到了国家自然科学基金、福建省自然科学基金、厦门大学校长基金、高等学校学科创新引智计划等的支持。
近年来,林圣彩教授以细胞代谢稳态调控为研究核心,针对细胞对营养物质与能量的感知机制以及代谢紊乱相关疾病的发生发展的分子机制进行研究,取得了一系列原创性成果,特别是发现和鉴定了细胞感应葡萄糖缺乏的溶酶体途径和所在的“葡萄糖感受器”,及其激活AMpK的方式,并打破了传统的“AMpK的激活仅依赖于AMp浓度的变化”的认知(Cell Metabolism, 2013, 2014; Nature, 2017; Cell Research, 2019)。基于本团队发现的溶酶体AMpK通路,他们揭示了二甲双胍激活AMpK是通过该通路(Cell Metabolism, 2016),以及AMpK依赖于不同应激的状态的时空调控(Cell Research, 2019),揭示了钙离子通道TRpV介导了缩醛酶感知葡萄糖到AMpK激活的过程,让葡萄糖感知的通路全线贯通(Cell Metabolism, 2019),围绕AMpK分别与Grahame Hardie和Michael Hall发表两篇重要综述(Cell Metabolism,2018,2020)。
论文链接:https://www.nature.com/articles/s41586-022-04431-8






























