Nature Medicine| 邓宏魁课题组和合作者在非人灵长类动物模型证实人多能干细胞...
2022年2月4日,北京大学基础医学院邓宏魁研究组、中国医学科学院/北京协和医学院彭小忠研究组和天津市第一中心医院沈中阳研究组合作在Nature Medicine发表题为Human pluripotent Stem Cell-derived Islets Ameliorate Diabetes in Nonhuman primates的研究论文,该研究首先在原有工作基础上进一步优化和改进了人多能干细胞向胰岛细胞的分化制备方案,获得了功能成熟的人多能干细胞分化来源的胰岛细胞;进一步将其移植入非人灵长类糖尿病动物模型中,系统评价了人多能干细胞分化的胰岛治疗糖尿病的安全性和有效性。
人多能干细胞具有无限增殖和分化为功能性细胞的潜能,这使得利用人多能干细胞来源的功能细胞有望用于多种重大疾病的治疗。糖尿病是威胁人类健康的重大疾病之一,会导致多种并发症的发生,并发症致残致死率极高,严重影响了患者的生活质量甚至危及生命。我国已经成为世界上糖尿病患病人数最多的国家,急需开发有效治疗糖尿病的新方法。目前临床胰岛移植治疗糖尿病已有成熟的技术方案和良好的临床效果,但人胰腺供体稀缺的问题,极大限制其广泛应用。人多能干细胞制备的胰岛细胞有望突破此瓶颈,是人多能干细胞在转化医学领域可能最快取得突破的方向。然而,人多能干细胞分化的胰岛用于临床糖尿病治疗的安全性和有效性,尚未得到系统研究和证实。
早在2005年,北京大学邓宏魁研究组率先采用模拟胰腺体内发育,分步定向诱导分化的策略,应用Activin A诱导小鼠多能干细胞分化成内胚层细胞,然后用视黄酸(Retinoic acid, RA)诱导细胞向胰腺命运特化,最后加入促进胰腺β细胞分化的因子,在体外分步诱导小鼠多能干细胞分化成为胰腺β细胞(Shi et al, Stem Cells, 2005)。该方法随后被德国Anna Wobus研究组进一步证实(Rolletschek et al, Diabetologia, 2006),Activin A和RA随后被广泛地用于诱导多能干细胞向胰腺β细胞定向分化的研究中。
2006年美国Novocell公司(现更名为ViaCyte公司)采用了邓宏魁研究组报道的Actinvin A和RA,并进一步加上其它诱导因子分步处理,将人多能干细胞诱导成胰岛素分泌细胞(D"Amour et al, Nat Biotechnol, 2006)。在2007年北京大学邓宏魁实验室也报道了在已有的工作基础之上建立的诱导人多能干细胞定向分化为胰腺β细胞的技术方案,并首次获得了能够改善小鼠糖尿病症状的人多能干细胞来源的胰腺β细胞(Jiang et al, Cell Res, 2007)。继人ipS细胞成功建系之后,张毅研究组以及邓宏魁研究组报道了人ipS细胞向胰腺β细胞的定向分化(Tateishi et al, J Biol Chem, 2008; Zhang et al, Cell Res, 2009);哈佛大学Douglas A. Melton研究组制备了糖尿病人特异性的ipS细胞,并将其诱导为胰腺β细胞(Maehr et al, proc Natl Acad Sci U S A, 2009)。这些研究进展为利用人多能干细胞治疗糖尿病奠定了早期的研究基础。
在本研究中,邓宏魁研究组大幅改进了人多能干细胞向胰岛细胞的分化方案,重点解决了如何高效率地诱导从胰腺前体细胞向胰岛内分泌细胞命运特化的难题(图1)。他们通过三维重构诱导前肠后部细胞形成胰岛样细胞球,并优化胰腺前体向内分泌前体细胞分化的诱导条件,最终能够在不同的供体来源的人多能干细胞株上实现稳定、高效的胰岛细胞诱导分化,获得结构和功能与人原代胰岛相似的人多能干细胞分化胰岛。将人多能干细胞分化胰岛移植入糖尿病模型小鼠体内,可以有效逆转糖尿病,而且在长达48周的观察周期中,所有移植小鼠中均未观察到移植细胞致瘤现象(图2)。
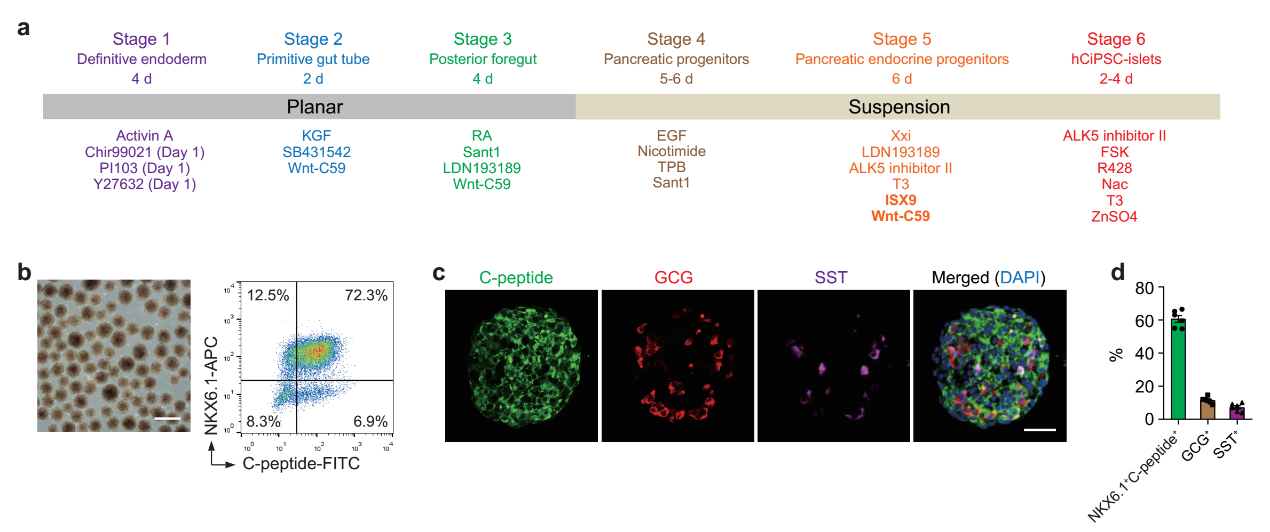
图1.人多能干细胞定向分化为胰岛细胞。
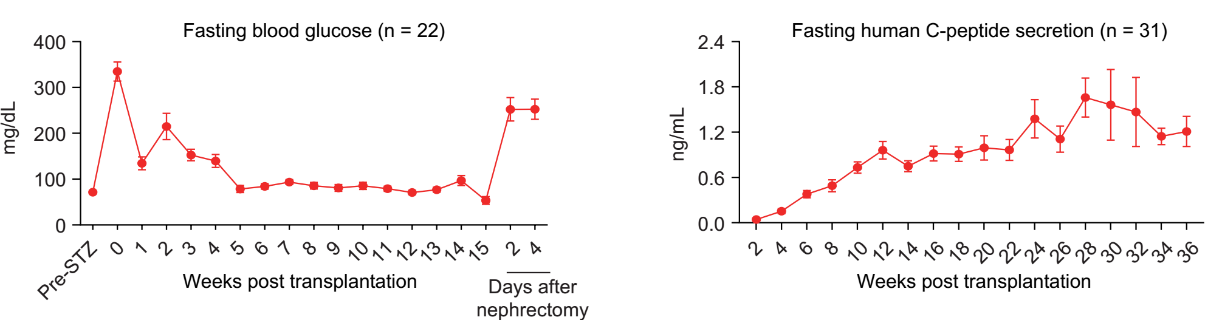
图2.人多能干细胞分化的胰岛细胞移植入糖尿病小鼠模型后逆转小鼠糖尿病。
在此基础上,研究团队进一步将人多能干细胞分化的胰岛细胞移植入糖尿病非人灵长类模型中,观察其长期安全性和有效性。非人灵长类动物模型在遗传学、解剖学、代谢和生理学方面与人类高度相似,使其成为非常理想的模型系统。研究团队使用临床常用的胰岛移植方案——肝门静脉移植,将人多能干细胞分化的胰岛细胞输注到糖尿病模型猴体内,受体猴的空腹血糖和平均餐前血糖显著降低。研究团队观察到,接受细胞移植的糖尿病猴的C肽(胰岛素分泌标记物)释放能够响应餐食或葡萄糖刺激。糖化血红蛋白(HbA1c)是临床常用的指标,用于综合评价糖尿病患者的中长期的血糖控制情况;HbA1c每降低一个百分点,糖尿病相关并发症的风险就会随之显著下降。值得指出的是,在4只长期跟踪观察的糖尿病模型猴上,HbA1c与移植前峰值相比,下降了2%以上。研究人员还发现,在一只血糖波动幅度大、控制整体较差的糖尿病模型猴上,移植人多能干细胞分化的胰岛细胞后其血糖的控制得到了明显改善。这一结果提示了人多能干细胞分化的胰岛细胞移植有望用于脆性糖尿病患者的治疗,可以有效降低脆性糖尿病患者的死亡风险。综上所述,该研究在非人灵长类动物糖尿病模型上长期系统地追踪观察,证明了人多能干细胞分化的胰岛细胞在糖尿病治疗中的安全性和有效性。
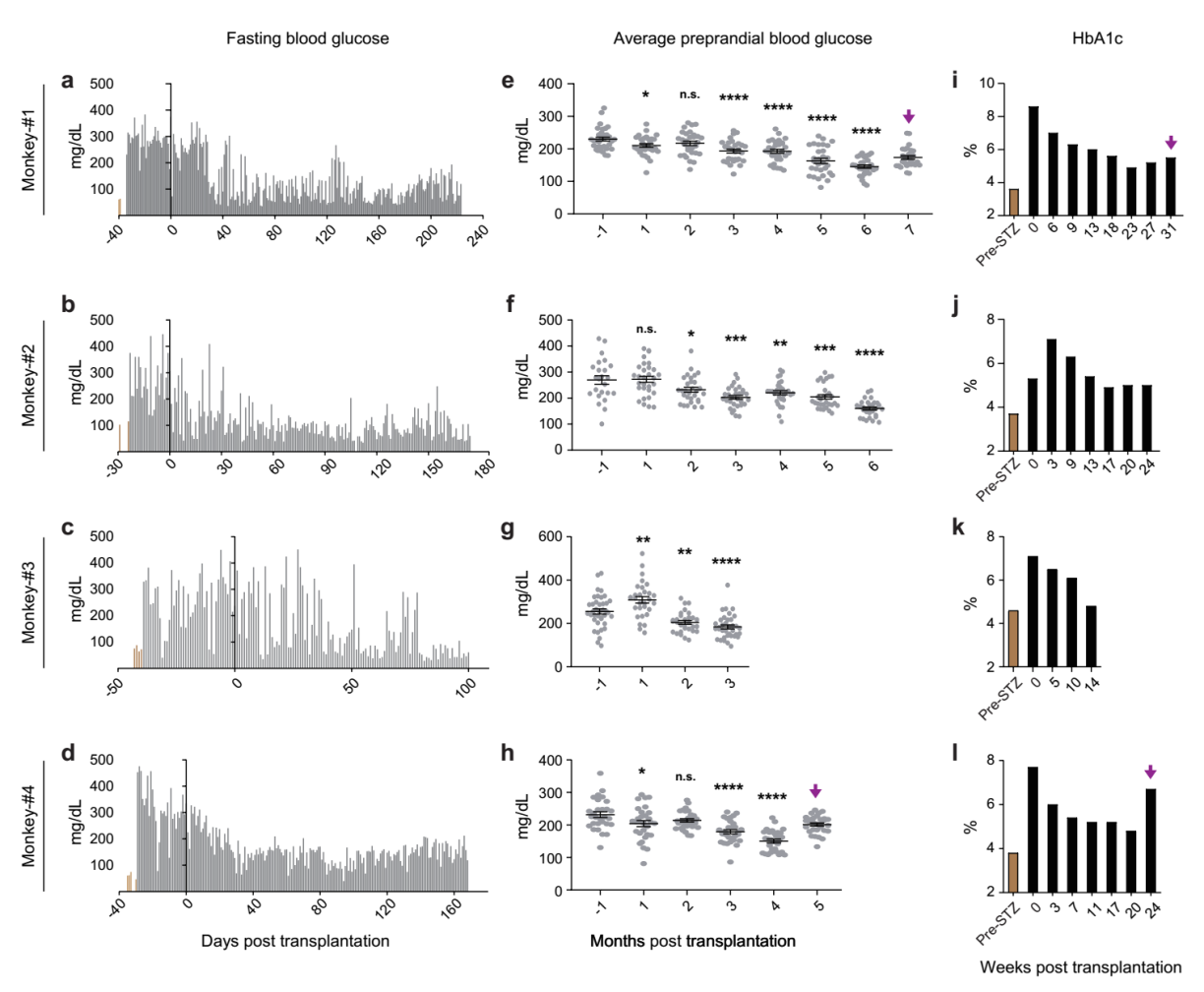
图3.人多能干细胞分化的胰岛细胞移植入糖尿病猴模型有效改善其血糖控制。
近期,利用人多能干细胞分化的细胞治疗糖尿病取得了一些重要的进展。美国ViaCyte公司尝试使用人多能干细胞分化的胰腺前体细胞结合大包囊装置进行糖尿病治疗,他们报道的17名患者中,部分患者在植入细胞后6个月,能够检测到低水平的C肽分泌;同时,患者达到目标血糖范围内的时间增加了13%。这一研究成果证明该方法的安全性,但也表明该方法获得的人多能干细胞分化的胰腺前体细胞与人原代分离的胰岛在临床疗效方面存在的显著差距。Melton团队与美国Vertex公司合作,直接利用人多能干细胞分化的胰岛细胞进行移植,并在首位细胞移植志愿者中,观察到了内源胰岛素分泌的明显恢复,且细胞移植后90天,患者每日胰岛素用量降低了91%。虽然仅有一例患者的数据报道,但该成果令人振奋。
本研究成功地在非人灵长类动物模型上证明了人多能干细胞分化的胰岛细胞在糖尿病治疗中的安全性和有效。该研究与Vertex报道的个例临床研究成果,充分展示了人多能干细胞来源的胰岛细胞在1型糖尿病治疗中的巨大潜力,该疗法有望成为治疗甚至治愈1型糖尿病的全新方案。
北京大学基础医学院邓宏魁教授、中国医学科学院/北京协和医学院彭小忠教授、天津市第一中心医院沈中阳教授为论文共同通讯作者。北京大学汤超教授和李程教授对本文有重要贡献。这项研究得到了国家重点研发计划项目、国家自然科学基金支持。这项研究也得到了清华大学-北京大学生命科学联合中心的支持。
原文链接 https://www.nature.com/articles/s41591-021-01645-7
(北京大学基础医学院)






























