细菌效应蛋白拮抗宿主抗细菌自噬的分子机理和细胞选择性自噬的通用机制
真核细胞的经典自噬是细胞在营养缺陷时实现胞内物质循环再利用的重要信号通路,越来越多的研究表明,自噬通路也可以选择性地感知并抵御入侵的病原细菌,这一过程也被叫做抗细菌自噬或者异源自噬(Xenophagy)。2019年北京生命科学研究所邵峰团队首次揭示了异源自噬的分子机制。细菌入侵宿主细胞后,细菌所在内吞泡上的V-ATpase感受到细菌感染引起的内吞泡破坏,招募自噬机器ATG16L1复合体活化自噬标记分子LC3,活化的LC3包裹含有细菌的内吞泡,进一步介导溶酶体融合和降解来限制病原菌的增殖和扩散。这项工作还发现沙门氏菌通过独特的效应蛋白SopF介导V-ATpase亚基VoC发生ADp-核糖基化修饰,特异地阻断V-ATpase和ATG16L1复合体的相互作用,从而拮抗宿主细胞的异源自噬抗细菌防御。但是效应蛋白SopF拮抗宿主异源自噬的精确分子机理,以及V-ATpase-ATG16L1通路触发异源自噬的可能机制还有待进一步完整揭示。
2022年1月19日,中科院生物物理研究所王大成/丁璟珒课题组和北生所邵峰团队合作,在《Nature Structural & Molecular Biology》发表题为"ARF GTpases activate Salmonella effector SopF to ADp-ribosylate host V-ATpase and inhibit endomembrane damage-induced autophagy"的研究论文。该研究揭示了SopF利用真核宿主细胞的小G蛋白ARF作为辅因子激活其ADp-核糖基转移酶活性、修饰V-ATpase亚基VoC拮抗宿主异源自噬的毒力机制,并阐明了V-ATpase-ATG16L1通路响应广泛的内膜系统损伤而激活细胞选择性自噬的通用机制。
利用细胞免疫共沉淀-质谱分析技术,研究人员首先鉴定出沙门氏菌效应蛋白SopF与宿主细胞中一类小G蛋白ARF 特异结合,并成功解析了SopF-ARF1蛋白质复合物及其与NAD+三元复合物的三维结构。结构分析与位点突变等实验证明SopF属于白喉毒素样ADp-核糖基转移酶家族,以 "I-Y-E"为核心基序结合细胞内的NAD+作为供体,催化底物V-ATpase 的VoC亚基第124位谷氨酰胺(Q124)发生ADp-核糖基化修饰。进一步细菌感染、体外生化重组等实验证明,SopF对VoC的修饰活性严格依赖GTp结合的激活形式ARF蛋白作为辅因子。这种细菌的毒力因子利用宿主蛋白的激活机制,反映了细菌在与宿主长期互作过程中进化出的一种精确调控的策略。
V-ATpase作为质子泵广泛地分布在多种酸化内膜细胞器的膜上,宿主细胞抗细菌异源自噬的工作原理,提示这些内膜细胞器的损伤也可能活化V-ATpase-ATG16L1通路启动细胞的多种选择性自噬。研究人员利用SopF作为研究V-ATpase-ATG16L1通路的工具发现,LLOMe、Nigericin或NH4Cl等破坏溶酶体的化合物强烈地诱导LC3激活并包裹受损的溶酶体,这一现象可以被效应蛋白SopF或VoC亚基的Q124A突变高效地抑制,表明这种针对溶酶体的细胞选择性自噬也是由V-ATpase-ATG16L1通路启动的。最新的研究进展表明,宿主抗病毒干扰素诱导通路的关键蛋白STING在结合了配体cGAMp后会转位至高尔基体发生寡聚化激活,这一过程也会诱导LC3激活并包裹高尔基体,SopF或VoC亚基的Q124A突变的抑制实验表明,这种针对高尔基体的细胞选择性自噬同样依赖V-ATpase-ATG16L1通路。更有趣的是,研究人员发现SopF或VoC亚基的Q124A突变并没有破坏V-ATpase的质子泵活性,定位在内膜细胞器上的V-ATpase通过感知酸性细胞器腔内pH的异常变化而来启动对ATG16L1复合体的招募和选择性自噬的发生。
这项研究工作揭示了细菌效应蛋白SopF拮抗宿主异源自噬的ADp-核糖基转移酶活性的结构基础以及依赖宿主小G蛋白ARF的调控机制,进一步发现了V-ATpase独立于质子泵功能、识别内膜系统损伤激活细胞非经典自噬的全新功能,并证实V-ATpase-ATG16L1通路是启动多种细胞选择性自噬的保守机制,为细胞内膜稳态维持与调控机制提供全新的研究方向。
中科院生物物理研究所丁璟珒研究员和北生所邵峰教授为本文的共同通讯作者,该研究得到科技部重点研发计划,中科院战略先导科技专项,基金委优青项目,以及中科院青促会项目的支持。
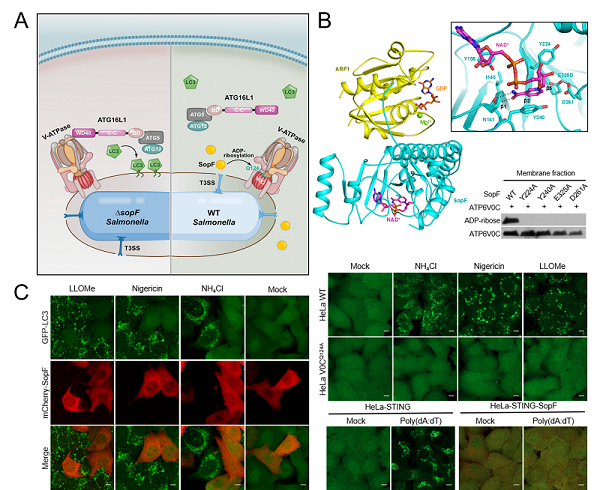
图 细菌效应蛋白SopF拮抗宿主抗细菌自噬的分子机理
A. 沙门氏菌效应蛋白SopF阻断V-ATpase-ATG16L1通路拮抗宿主抗细菌自噬的模式图;B. SopF-ARF1-NAD+三元复合物结构和酶活中心展示,以及SopF对V-ATpase亚基VoC的ADp-核糖基化修饰;C. SopF阻断多种内膜细胞器损伤引起的选择性自噬。
文章链接:https://www.nature.com/articles/s41594-021-00710-6
(供稿:王大成/丁璟珒研究组)






























