生物治疗国家重点实验室钱志勇教授团队在Advanced Functional Materials发表封面文章:揭示超声/激光...
华西医院生物治疗国家重点实验室钱志勇教授团队近日在Advanced Functional Materials杂志(影响因子:18.808,在JCR“物理,应用”类别160种期刊中排名第8位)发表封面文章(Front Cover) “Trimodal Sono/photoinduced Focal Therapy for Localized prostate Cancer: Single-Drug-Based Nanosensitizer under Dual-Activation”(图1、图2),揭示了超声/激光介导的单一纳米敏化剂在局限性前列腺癌治疗中的应用,为开发新一代高效低毒的前列腺癌局部消融疗法提供借鉴与参考。

(图1)

(图2)
随着临床上用于早期前列腺癌筛查的相关技术的普及,越来越多的男性被诊断为早期的局限性前列腺癌。对于局限性前列腺癌患者,临床上主要的两种处置方式为全腺体根治性治疗和主动监测。虽然前列腺切除术和放疗等根治性疗法能够提高部分局限性前列腺癌患者的5年生存率,但其不可避免地带来了患者排尿困难、尿失禁、勃起功能障碍等副作用;主动监测前列腺癌的进展需要进行频繁的检查,并且患者可能会错过干预癌变的良好时机,从而影响肿瘤预后。因此,制定一个介于根治性治疗和主动监测之间的“中间”策略是非常有必要的,在达到治疗效果的同时,减轻患者身体负担。
近年来,超声和激光介导的局部消融治疗成为一种有潜力的早期局限性前列腺癌替代疗法。单一声疗(声动力治疗,SDT)的活性氧(ROS)产率低,而单一光疗(主要包括光动力治疗pDT和光热治疗pTT)的组织穿透性不足。如果将二者联合起来,使用超声和激光共同激发一种药物(声/光敏剂),不仅能够克服单一声疗/光疗的缺点,而且有望取得理想的高效低毒的声/光疗协同抗肿瘤作用。使用较小剂量的声/光敏剂和较低能量的声源/光源,还能降低对机体造成的毒副作用。
基于此,为了提高声/光疗联用在局限性前列腺癌治疗中的适用性,钱志勇教授团队构建了一种基于天然高分子多糖化学修饰策略的声/光敏剂前药自组装纳米粒,其具有肿瘤靶向作用、线粒体选择性蓄积和氧化还原/酶响应等特点(图3)。
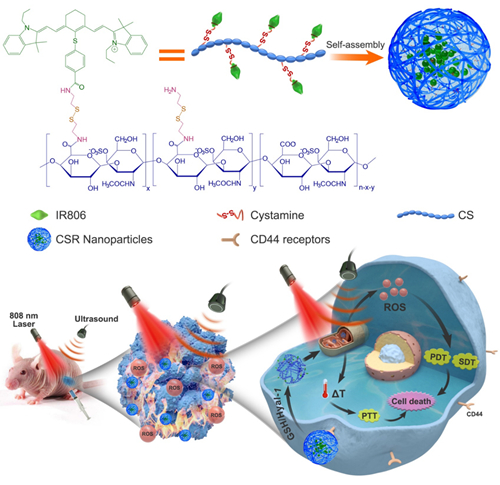
(图3)
多功能CS-ss-IR806 (CSR)纳米粒的构建,及其在超声/激光诱导下发挥三模态的声动力治疗(SDT)、光动力治疗(pDT)和光热治疗(pTT)治疗局限性前列腺癌的示意图
该研究首先合成了游离声/光敏剂IR780的羧基化衍生物IR806,然后利用化学偶联法将IR806通过具有还原响应性的二硫键与高分子多糖硫酸软骨素(CS)进行键合,得到了两亲性的CS-ss-IR806(CSR)偶联物,其可在水中发生自组装形成球形CSR纳米粒(CSR-Nps)。与游离IR780和游离IR806相比,CSR-Nps表现出显著的水分散性(超过10000倍)、更低的暗毒性和更好的生物相容性。值得一提的是,CSR-Nps在超声/激光联合照射下产生了良好的热疗效应和ROS生成能力。采用瘤内注射极低剂量的CSR-Nps(0.4mg/kg)到pC3荷瘤小鼠体内,然后进行超声/激光双重照射,与单次照射相比,产生了显著的三模态抗癌效果。
研究进一步证实,这种协同抗肿瘤效应主要归功于声疗和光疗的互补机制:先遣的超声作用产生的机械效应可以促进注射药物在整个肿瘤内的分布,从而提高后续的光疗效果。针对目前早期前列腺癌治疗的临床挑战,本研究工作有望为开发新一代高效低毒的前列腺癌局部消融疗法提供借鉴与参考。
华西医院生物治疗国家重点实验室、康复医学四川省重点实验室、康复医学研究所为本研究的第一完成单位和通讯单位。华西医院生物治疗国家重点实验室/生物治疗研究中心钱志勇教授为通讯作者。博士后胡丹蓉和硕士研究生潘梦(首届华西生物国重创新班药学专业学生)为共同第一作者。上述研究得到了国家自然科学基金杰出青年基金、国家自然科学基金重点项目、国家自然科学基金面上项目、华西医院135高端人才支持计划等项目的支持。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202170367






























