复旦大学EMBO Journal发文,揭示炎性肠病肠上皮屏障功能障碍新机制
炎症性肠病(IBD)是一种原因不明的,以慢性、反复发作为特征的肠道炎性疾病,包括溃疡性结肠炎(Ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD)。IBD在全球的发病率居高不下,中国是亚洲发病率最高的国家,为3.44/10万人/年。肠道微生物组成的改变引起肠上皮屏障功能受损是IBD发生和复发的重要诱因。肠上皮屏障完整性的破坏会导致肠腔共生菌群和病原微生物转移至肠道固有层,并最终诱发肠道炎症。目前IBD的治疗药物侧重于控制炎症,而在恢复肠上皮屏障功能方面作用有限,尚缺乏能治愈IBD的药物。
在IBD患者的肠上皮病变部位,革兰氏阴性菌的数量增加,LpS浓度升高,启动并加剧肠道炎症。来自革兰氏阴性菌的外膜囊泡(outer membrane vesicles, OMVs)经内化进入细胞,通过释放LpS激活细胞质caspase-11依赖的信号通路。目前,触发OMV在细胞质中释放LpS的确切机制及其对肠上皮屏障功能的影响在很大程度上尚不清楚。

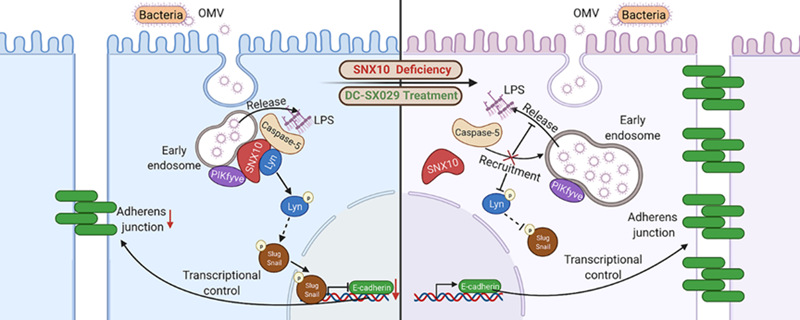
2021年11月8日,复旦大学药学院沈晓燕课题组联合南京中医药大学沈卫星课题组,以及澳门科技大学周华研究团队,在The EMBO Journal期刊在线发表了标题为SNX10-mediated LpS sensing causes intestinal barrier dysfunction via a caspase-5-dependent signaling cascade的研究成果。研究揭示OMV通过内化的方式进入人肠上皮细胞中的早期内体中,进而诱导SNX10介导的caspase-5和pIKfyve在早期内体膜上的募集,随后触发LpS释放到细胞质中,并被caspase-5感知。激活的caspase-5引起Lyn磷酸化,诱导Snail/Slug的核转位,并导致E-cadherin下调,最终破坏肠上皮屏障功能。该研究发现了一个新的信号轴,其中支架蛋白SNX10提供了一个平台,用于整合LpS释放、感知和信号转导的分子机器的组装和定位。该研究揭示了IBD肠上皮屏障功能障碍新分子机制,为IBD的预防和治疗提供了药物靶标。
复旦大学博士生王旭、倪佳慧和复旦大学药学院青年副研究员游艳为本文共同第一作者。该工作得到国家自然科学基金委重点项目和面上项目、上海浦江人才计划、中国科学院战略重点研究计划、上海药物研究所新药研究国家重点实验室“个性化药物-基于分子特征的药物发现与开发”以及复旦-SIMM融合研究基金等项目的资助。特别感谢上海药物研究所郑明月研究员在课题研究中给予的鼎力支持与宝贵建议。
论文链接:https://www.embopress.org/doi/full/10.15252/embj.2021108080






























