基础医学院郑俊克课题组在Blood发表骨髓微环境组分维持造血干细胞干性新...
近日,基础医学院郑俊克研究员课题组在血液领域国际著名期刊Blood在线发表了题为“Endothelial cell-derived angiopoietin-like protein 2 supports hematopoietic stem cell activities in bone marrow niches”的研究论文。
造血干细胞(hematopoietic stem cells, HSCs)具有自我更新和分化成所有造血细胞的能力,是维持人类正常生命功能的重要成体干细胞之一。随着骨髓移植技术的发展,HSCs已被广泛应用于临床治疗各种血液系统疾病,如白血病、淋巴瘤、贫血以及免疫性疾病等。成体HSCs位于骨髓一个非常特殊的微环境(Niche),骨髓Niche中存在的各种类型细胞及其分泌的有关成分精细调控着HSCs的多种命运,包括自我更新、迁徙、分化和凋亡等。解析骨髓Niche相关成分及其调控HSCs命运的作用机制,有助于理解HSCs干性(即自我更新和分化能力)维持、衰老、恶性转化的分子基础,同时为HSCs的体外扩增和临床应用寻找新的突破口。
该研究通过特异敲除小鼠Niche内皮细胞、间充质干细胞和巨核细胞中血管生成素样蛋白2(angiopoietin-like protein 2,Angptl2)的表达,证实只有血管内皮细胞来源的ANGpTL2能够维持HSCs的自我更新能力。敲除内皮细胞来源Angptl2可导致HSCs在血管周微环境定位能力下降和静息状态的丧失。在机制方面,内皮细胞来源Angptl2的缺失可导致细胞周期调控蛋白G0s2显著下调,并进一步影响核素定位而导致G0期逃逸;ANGpTL2主要通过维持ppARD水平而直接转录调控G0s2的表达以实现对HSCs干性精细调控。这些研究成果不仅有助于理解骨髓微环境中HSCs干性维持的微环境成分的特定组成和作用基础,也为HSCs的体外扩增与应用以及白血病的靶向治疗策略的开发提供新的思路。
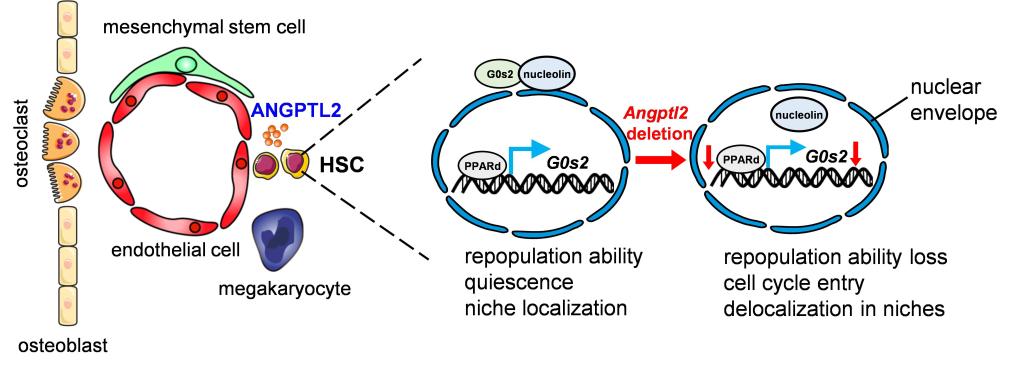
骨髓微环境内内皮细胞来源ANGpTL2调控HSCs干性的工作模式图
基础医学院病理生理学系于卓研究员和博士研究生杨文倩为该论文并列第一作者,郑俊克研究员、于卓研究员、张亚萍助理研究员和谢莉实验师为该论文共同通讯作者。该工作得到了基础医学院生化系刘俊岭教授的大力支持和帮助,并受到国家杰青项目、国家重点研发计划、上海市科委自然科学基金项目等资助。






























