华中科技大学PNAS最新发文:力学调控肿瘤单细胞异质性新机制
12月16日,我校生命科学与技术学院李一伟教授团队和麻省理工学院机械工程系郭明教授团队在国际著名期刊美国国家科学院院刊pNAS 发表了题为“Volumetric compression develops noise-driven single cell heterogeneity”的研究文章。
华中科技大学生命学院为该论文第一单位,生命学院李一伟教授和麻省理工学院机械工程系郭明教授为该论文的共同通讯作者。该研究得到国家自然科学基金(32171248, 12102142),中央高校基本科研业务专项资金(2021GCRC056)的资助。本研究也得到了墨卓生物郑文山博士的技术支持。
肿瘤组织的异质性是当前研究的热点之一。肿瘤内细胞与细胞间的异质性,为癌症的诊断,治疗以及相关药物的开发带来了极大的困难。人体的多细胞系统,包括器官、肿瘤、和胚胎均由异质且相关的单细胞组成,但均发源于同质且均一的细胞类群。了解异质且有序的生物系统如何从同质且单一的细胞中发展而来是生命科学的根本问题之一。现今的研究认为生物异质性的主要来源有:基因组的不稳定性,程序化细胞分化,基因突变的累积,或者是时空间有序的生长因子信号刺激。尽管各种生化因素和遗传因素的单细胞异质性来源被逐步揭示,由微环境中物理力学因素导致的细胞异质性起源机制,并不明确。
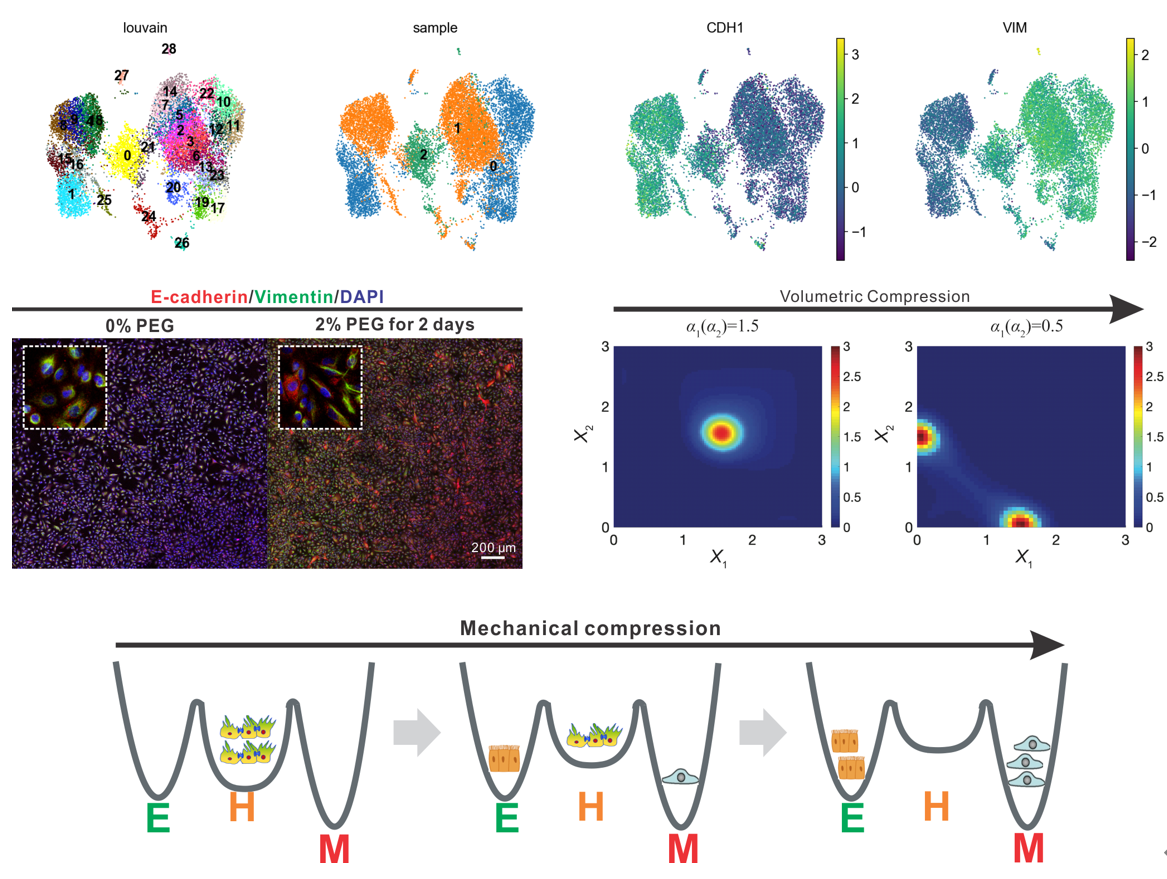
本研究采用单细胞测序技术、单分子荧光原位杂交技术直接追踪肿瘤单细胞基因表达的变化,通过渗透压挤压模拟肺癌患者肺部力学微环境的改变。本研究清楚发现,单一种类的力学信号,可以在同一种均质的非小细胞肺癌细胞中诱导出两种截然不同的细胞表型,并导致单细胞异质性的产生。研究发现,力学诱导的新型细胞亚型具有皮质间充质转化相关的特征基因,和肿瘤干细胞相关的特征基因。对皮质间充质转化的基因调控网络进行数学建模发现,初始的同质非小细胞肺癌细胞处于该调控网络中的中间态,即皮质/间充质杂合态。力学诱导所产生的细胞分别位于中间态两侧的“皮质”和“间充质”两种稳态。力学挤压增强了单细胞间基因表达的噪音(变异系数),这就导致细胞的转录谱偏离细胞原来所处的中间稳态,使细胞随机向调控网络中另外两个稳态进行转变,最终形成了细胞命运的双向转化这一现象。本研究的理论计算、分子实验结果、单细胞测序结果均支持这一可能机制。
我校生命学院李一伟教授2020年底从麻省理工学院回国加入到本院任教,团队关注生命过程中的物理现象,包括:类器官力学生物学,相分离组学等。近2年来陆续揭示细胞内分子拥挤介导的力学调控干细胞/类器官命运转变(脂肪干细胞重编程、肌肉组织分化、小肠类器官重编程),力学调控信号通路(Wnt/β-catenin signaling),力学调控信号体相分离(LRp6-AXIN signalosome)和力学调控基因统计学表达造成的肿瘤异质性(Cell Stem Cell, 2021; pNAS, 2021; Matter, 2021; Materials Today 2021; Science Advances, 2020; pNAS, 2019; Analytical 20201; Lab Chip 2021)。李一伟教授团队招收涉及干细胞/类器官培养、生物物理/细胞力学、单细胞组学技术等各领域相关的本科生、研究生、博士后和研究助理,欢迎有热情、热爱科研的优秀学子与李一伟教授直接联系。






























