王恩多组合作揭示人源DNMT2识别底物tRNA的分子机制
12月7日,国际学术期刊Nucleic Acids Research 在线发表了中国科学院分子细胞科学卓越创新中心王恩多研究组和上海科技大学刘如娟课题组的最新研究成果“position 34 of tRNA is a discriminative element for m5C38 modification by human DNMT2”,揭示了人源DNMT2识别底物tRNA的分子机制。
真核基因的表达调控是一个非常复杂的过程,涉及到转录调控和翻译调控等多个方面。在翻译调控中,转移核糖核酸(transfer RNA, tRNA)是蛋白质翻译过程中重要的“接头分子”,起着遗传信息从核酸到蛋白质的解码作用。tRNA上存在着数量最为密集、种类最为繁多的转录后修饰,这些修饰对蛋白质翻译的精确调控起关键作用。5-甲基胞嘧啶(m5C)修饰广泛存在于高等真核生物tRNA上,主要由tRNA修饰酶NSun2、NSun3、NSun6和DNMT2负责催化。其中,DNMT2所催化的tRNA上的m5C修饰调控小鼠精子中tRNA来源的片段(tRNA fragment, tRF)的生成从而影响子代代谢水平。
2006年首次报道的DNA甲基转移酶家族成员DNMT2是一个tRNA甲基转移酶,它催化底物tRNA第38位m5C修饰,可是人源DNMT2识别底物tRNA并催化m5C修饰的分子机理并不清楚。研究团队首先从tRNA数据库中筛选到十三种第38位是胞嘧啶的tRNA,通过酶活力测定发现DNMT2能够催化修饰tRNAAsp(GUC)和tRNAGly(GCC),进而发现底物tRNA第34位摆动碱基G是关键的识别位点。此外,研究人员进一步发现,DNMT2对tRNAVal(AAC)的底物识别和修饰依赖于ADAT2/3酶复合物先将tRNA第34位A修饰成次黄嘌呤(I),表明tRNA第34位的A-to-I修饰介导了第38位的m5C修饰的发生。同时,研究团队发现DNMT2识别底物也依赖于tRNA反密码子环的关键序列C32U33(G/I)34N35(C/U)36A37C38(N表示任意核苷酸,32-38表示tRNA上碱基位置);此外,DNMT2对底物tRNA的识别还依赖于D茎,可变环的关键序列和tRNA完整的三级结构。
该研究首次明确了人源DNMT2的识别底物tRNA的分子机制,并发现该机制在高等哺乳动物中较为保守,为揭示哺乳动物中DNMT2发挥RNA修饰酶的催化功能提供了理论基础。
分子细胞卓越中心王恩多研究员和上海科技大学生命科学与技术学院刘如娟教授为本文的共同通讯作者,王恩多组博士研究生黄志宣为第一作者。该研究工作得到了国家重点研发计划和国家自然科学基金的经费支持。
文章链接:https://doi.org/10.1093/nar/gkab1148
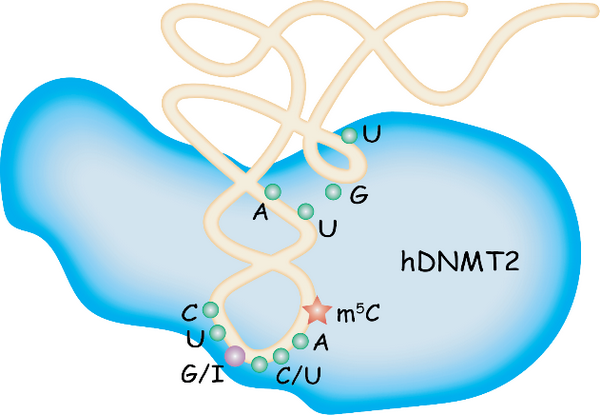
人DNMT2识别tRNA底物示意图






























