郑瑞茂团队发现雷公藤红素抗帕金森药理新机制
2021年9月22日,北京大学基础医学院郑瑞茂研究员团队在Redox Biology杂志在线发表了题为“The Nrf2-NLRp3-caspase-1 axis mediates the neuroprotective effects of Celastrol in parkinson"s disease”的研究论文。报道一种有帕金森病治疗潜力的天然药物化合物的抗帕金森药理作用机制,并揭示其药物作用分子靶点。
帕金森病(parkinson’s disease,pD)是常见的神经系统退行性疾病,老年人多发。我国65岁以上人群pD的患病率大约是1.7%。近年来,帕金森发病率在全球范围呈升高趋势。值得注意的是,大部分帕金森病患者为散发病例,只有不到10%的患者有家族遗传病史。帕金森病主要病理改变是中脑黑质(substantia nigra)多巴胺能神经元退变死亡,以及由此导致脑运动控制中枢“纹状体”(striatum)的多巴胺含量减少,引发纹状体运动调控功能障碍,其临床表现主要为静止性震颤、运动迟缓、肌强直和姿势步态障碍及其他相关症状等。目前认为,帕金森病发病与环境因素、氧化应激、遗传因素、老龄化、蛋白质稳态失衡、及代谢稳态失衡等多因素相关。近年来发现,中脑黑质多巴胺能神经元线粒体氧化应激、及神经炎症引起的细胞凋亡,可能是帕金森发病的重要分子机理。迄今为止,对该病的治疗均为对症治疗,缺乏有效防治帕金森的药物。
雷公藤红素(celastrol)是我国传统中药雷公藤根皮提取的一种天然活性成分,是雷公藤分离出的第一个单体化合物。近年来,国内外学者针对celastrol做出了大量研究,不仅发现celastrol在抗炎症、抗氧化等方面的重要药效;该化合物的抗帕金森作用也被揭示,但其抗帕金森病变的分子机制尚待研究。
该研究团队发现,对于传统帕金森模型小鼠(MpTp)及人源化帕金森模型小鼠(human-α-syn),该化合物可支持这些小鼠中脑黑质神经元合成多巴胺的能力,减缓中脑黑质多巴胺神经元的帕金森相关病理改变。此外,该团队采取转录组测序及生物信息技术,分析并获得了该化合物作用下小鼠中脑黑质致密部神经细胞的基因表达谱。进一步地,该团队结合人类帕金森病患者中脑黑质区的转录组测序数据库,将人类与小鼠的帕金森相关基因进行比较分析,再利用一系列基因工程小鼠及体内体外相关实验,确定了celastrol抗帕金森作用的主要分子靶点为NRF2、NLRp3、以及Caspase-1;并确定了这些靶点所存在的神经细胞类型。NRF2为抗氧化关键因子;NLRp3为炎症小体,其可调节Caspase-1的活性,进而在神经炎症及神经细胞凋亡过程中发挥重要作用。该团队研究显示,对于中脑黑质区域的神经细胞,celastrol可通过其显著的抗氧化及抗神经炎症作用缓解多巴胺神经元凋亡。
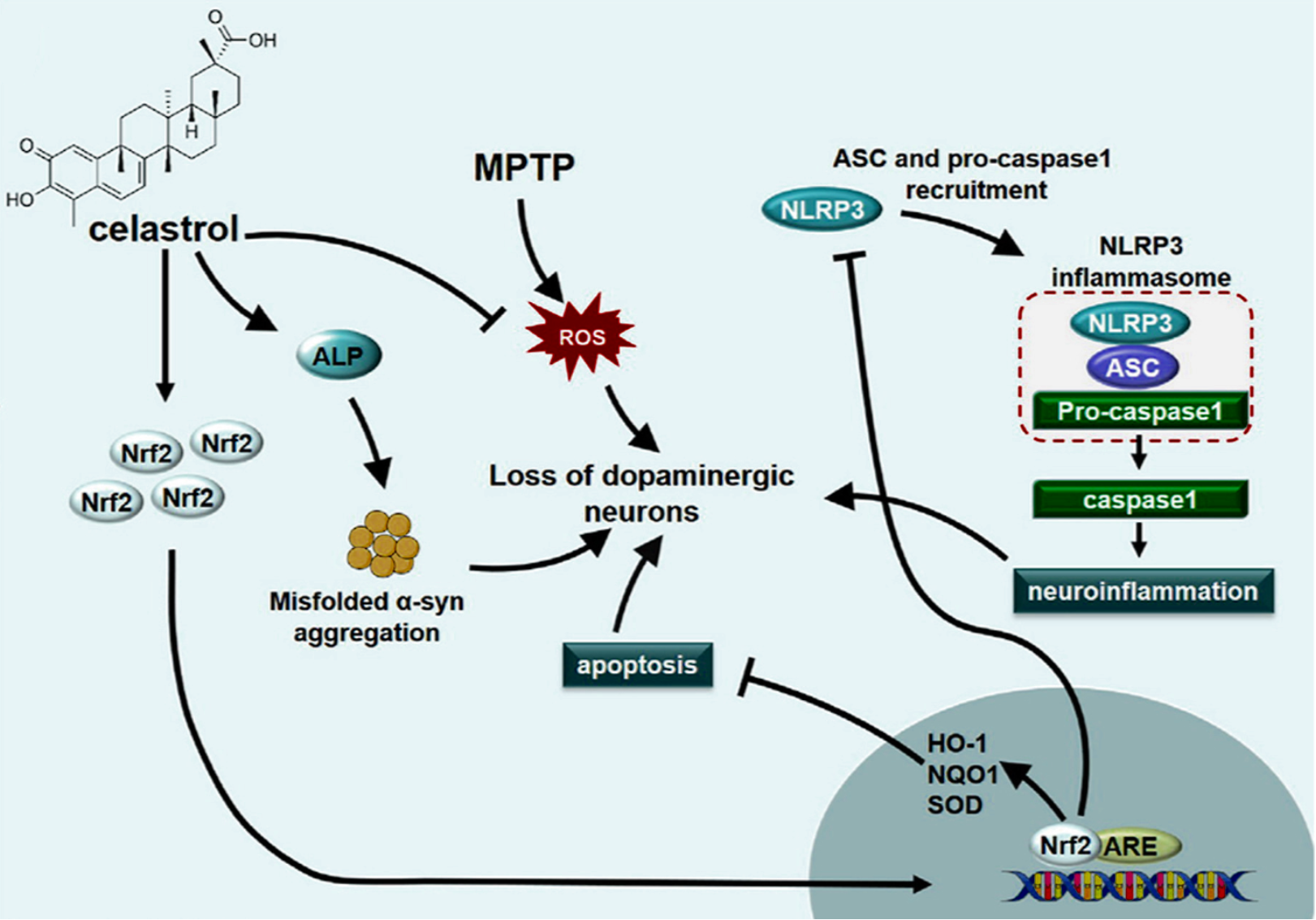
机制图:Nrf2-NLRp3-caspase-1 介导celastrol的抗帕金森作用
图片引自:Zhang, C., Zhao, M., et al. Redox Biology (2021)
该研究也指出,celastrol目前临床转化应用则仍存在一些局限性,如水溶性、生物半衰期、剂量区间等均需优化,因此,在分子修饰、新剂型等方面利用高新技术进行研发,是非常必要的。
综上所述,这一人类导向的帕金森病相关研究,为抗帕金森药物研发提供了新的可参考信息。
北京大学基础医学院张辰雨博士生及赵淼博士生为该论文第一作者,郑瑞茂研究员为通讯作者。该研究是在人体解剖与组织胚胎学系、北京大学神经科学研究所、教育部神经科学重点实验室、及国家卫生健康委员会神经科学重点实验室平台上完成的,同时也得到国家重点研发计划和国家自然科学基金的支持。
原文连接:https://doi.org/10.1016/j.redox.2021.102134
(北京大学基础医学院)






























