孔炜团队与合作者发现新的内源性血管钙化抑制因子并揭示其分子机制
2021年12月6日,北京大学基础医学院生理学与病理生理学系孔炜教授团队在《Circulation Research》上在线发表了题为“Unspliced XBp1 Counteracts β-catenin to Inhibit Vascular Calcification”的研究论文,报道了非剪接型XBp1对血管钙化及β-catenin信号的重要调控作用。
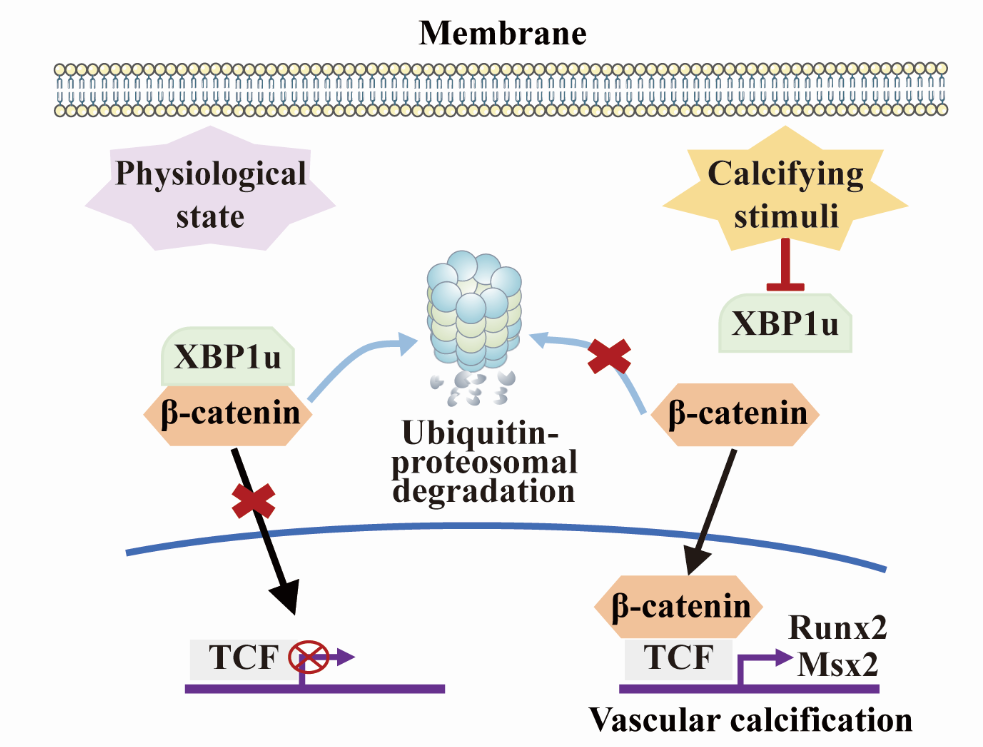
XBp1u通过促进β-catenin降解抑制血管钙化
血管钙化是指钙磷结晶在血管壁的异常沉积,是动脉粥样硬化、慢性肾病、糖尿病等的重要并发症。越来越多的研究表明血管钙化是心血管疾病的独立危险因素,但目前尚无有效的干预方法。该研究发现,非剪接型XBp1(unspliced XBp1,XBp1u)在慢性肾病患者及慢性肾病小鼠的钙化血管中表达下调。XBp1u在血管平滑肌细胞的敲低能促进高磷诱导的Runx2和Msx2等钙化标志物的表达和平滑肌细胞钙化。而在腺嘌呤饮食喂养或5/6肾切诱导的小鼠慢性肾病小鼠模型中,平滑肌细胞特异性缺失XBp1小鼠也出现了比对照小鼠更加严重的血管钙化,提示XBp1u是新的内源性血管钙化抑制因子。
β-catenin信号在胚胎发育、肿瘤发生和血管钙化等过程中均发挥着关键的调控作用。研究针对XBp1u进行蛋白质相互作用分析,发现XBp1u通过其C端的降解结构域直接结合β-catenin,促进β-catenin的泛素-蛋白酶体降解,阻断β-catenin对下游靶基因Runx2和Msx2等的转录激活,从而抑制血管钙化的发生。而该过程并不依赖于以GSK-3β为核心的经典破坏复合物,说明XBp1u介导的降解是β-catenin信号调控的新机制。
北京大学基础医学院杨柳博士为论文第一作者,北京大学基础医学院孔炜教授、博士后李芷晴博士和浙江大学附属第一医院徐清波教授为论文的共同通讯作者。该工作还得到了北京大学基础医学院赵颖教授和上海中医药大学附属曙光医院叶朝阳主任的支持。该项研究获得国家自然科学基金创新群体、国家自然科学基金重点项目和国家重点研发计划等资助。
原文链接:https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.121.319745
(北京大学基础医学院)






























