南京大学赵权教授课题组揭示人血红蛋白基因表达调控新机制
人类β-样珠蛋白基因以组织和发育时期特异性的方式表达,并且呈现出与染色体基因位置排布一致的表达顺序:5’-ε-Gγ-Aγ-δ-β-3’。人出生后不久胎儿期γ-珠蛋白(γ-globin)基因沉默表达,成体则主要表达β-珠蛋白(β-globin)在红细胞中与a-珠蛋白组成血红蛋白四聚体(HbA : α2β2)运载氧气。血红蛋白异常是世界上最常见的单基因遗传疾病,全球约7%的人群受其影响。β-珠蛋白基因突变形成异常HbA,可以导致镰刀型细胞贫血症、β-地中海贫血症等β-珠蛋白遗传疾病。然而,研究表明激活β-珠蛋白遗传疾病患者体内沉默的γ-珠蛋白基因的再次表达可以极大缓解这些患者的临床症状。因此研究胎儿期γ-珠蛋白基因表达的分子切换机制一直是近百年来的科学研究热点。
南京大学生命科学学院赵权教授课题组多年在红系细胞基因表达调控机理及其在遗传性血液病治疗应用方面开展深入研究,以人珠蛋白基因簇为研究模型,应用生物化学及表观遗传学等方法,发现并解析多个转录因子和表观遗传修饰分子及其复合体对人珠蛋白基因表达的精细调控机理,为镰刀型细胞贫血和β-地中海贫血治疗及临床转化应用打下良好基础。
近期该课题组通过蛋白互作质谱组学分析鉴定并发现核仁旁斑蛋白NonO是抑制人γ-珠蛋白基因表达的新转录因子。研究首次证实SOX6与NonO之间存在直接相互作用,二者协同沉默人γ-珠蛋白的基因表达(图1)。NonO蛋白可以直接结合在γ-珠蛋白基因近端启动子上特异抑制γ-珠蛋白基因的表达。研究人员分别使用人红白血病细胞、脐带血来源的永生化红系祖细胞以及骨髓来源的原代造血干细胞等体外细胞模型对NonO进行生物学新功能分析鉴定。在此基础上,研究人员进一步在携带人源β-珠蛋白基因簇的YAC小鼠体内通过对血液系统中NonO基因的条件性敲除,验证NonO对人γ-珠蛋白基因和小鼠胚胎期珠蛋白基因表达的抑制作用,提示该调控机制的物种保守性。这些研究结果为β-珠蛋白异常相关的血红蛋白疾病的治疗提供潜在新治疗靶点,具有较好的临床应用价值。
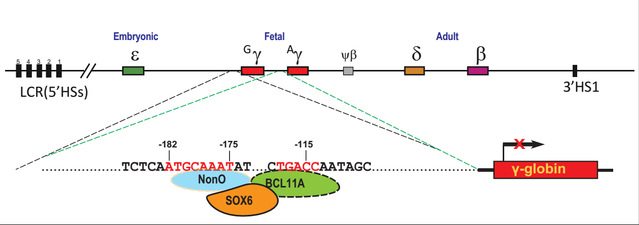
图1.转录因子NonO 调控人γ-珠蛋白基因表达的分子机制模式图
相关研究成果于2021年8月11日以“Transcriptional silencing of fetal hemoglobin expression by NonO”为题在国际著名学术期刊《Nucleic Acids Research》(IF: 16.97)上在线发表,南京大学生命科学学院博士研究生李新宇为论文的第一作者,赵权教授和刘明副研究员为通讯作者。

该研究课题得到国家自然科学基金和中央高校基本科研基金项目的支持。
论文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab671/6348189






























