黄卓研究团队在《Nature Communications》上发表难治性颞叶癫痫研究新成果


2017年8月25日,我院天然药物及仿生药物国家重点实验室黄卓研究团队在国际著名学术期刊《自然·通讯》(Nature Communications)杂志上在线发表了题为“CDYL suppresses epileptogenesis in mice through repression of axonal Nav1.6 sodium channel expression”的研究论文。该研究首次证明了表观遗传因子CDYL调控轴突起始段Nav1.6钠离子通道的表达,进而影响癫痫的发生发展,为癫痫的治疗提供了新的分子靶点。黄卓研究团队的博士研究生刘永清、赖世荣为本论文的共同第一作者,北京大学药学院天然药物及仿生药物国家重点实验室为第一责任通讯单位。
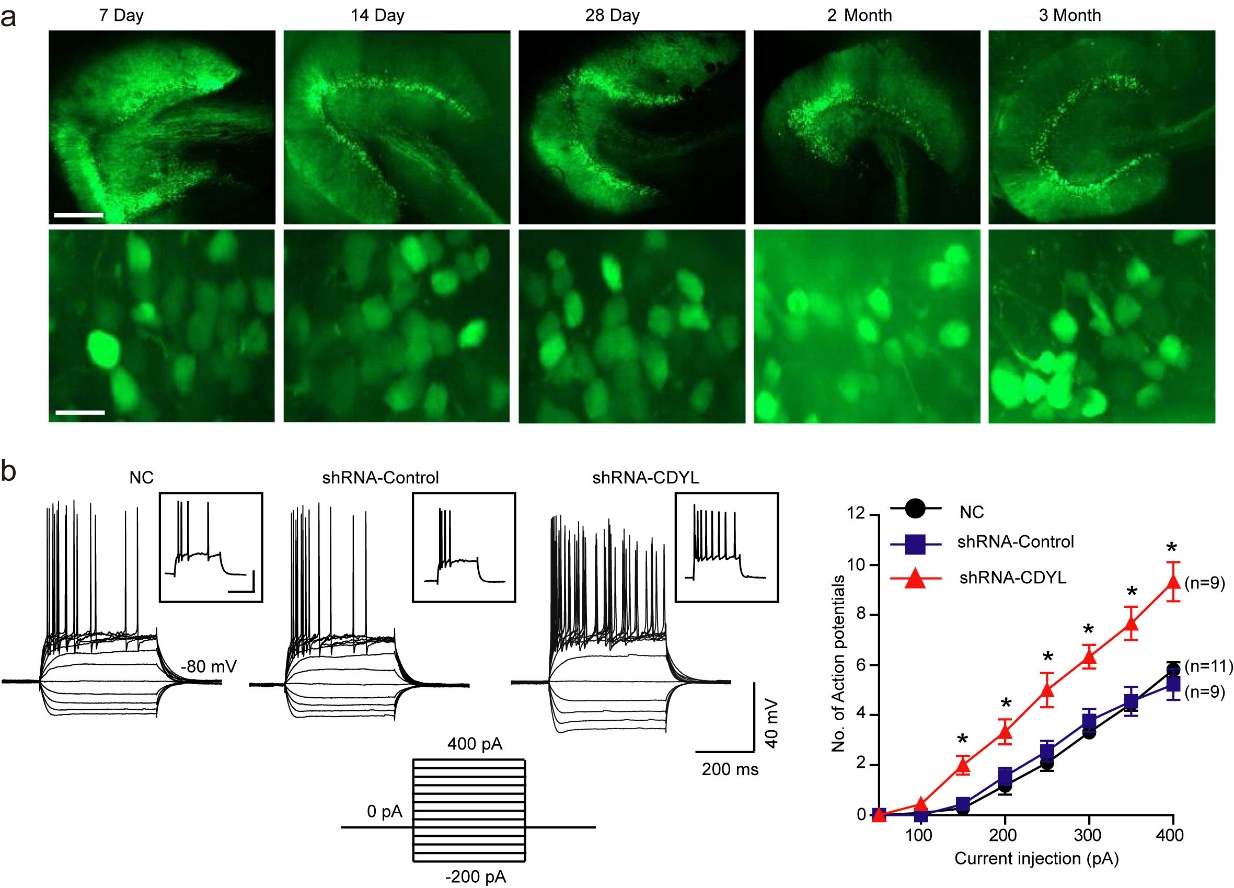
图一 a.大鼠背侧海马齿状回颗粒细胞病毒表达荧光示意图。感染病毒后7天,14天,28天,60天,90天表达情况。比例尺,500微米(上),15微米(下)。b. 电流钳记录颗粒细胞电压电流示意图。颗粒细胞分别感染CDYL-shRNA慢病毒,CDYL-shRNA对照慢病毒,和正常对照组。给细胞注入一系列以50皮安为梯度的电流,持续400毫秒,将细胞维持在-80毫伏,记录细胞动作电位。统计细胞动作电位个数。*p<0.05,单因素方差分析。
癫痫,俗称“羊癫疯”,是大脑神经元突发性异常放电导致短暂的大脑功能障碍的一种慢性疾病。据最新资料显示,我国癫痫的总体患病率为0.7%。癫痫分为原发性癫痫和继发性癫痫。普遍认为原发性癫痫与遗传因素有一定关系,而继发性癫痫又称获得性癫痫,产生的原因主要是颅脑外伤、感染、脑肿瘤、脑血管疾病等。现行的癫痫治疗方法主要是药物治疗和手术治疗,这些治疗手段都只能缓解癫痫症状,而不能从根本上治疗癫痫。在所有的癫痫病人当中,百分之三十以上病人患的是药物无法治疗的难治性癫痫,其中最常见的一种就是颞叶癫痫。颞叶癫痫是一种继发性癫痫,主要由脑外伤所引起,海马组织是其主要的原发区之一。
黄卓研究团队以难治性颞叶癫痫为攻克难点展开研究,探究颞叶癫痫的潜在机制,寻找潜在的治疗靶点。而神经元上的离子通道是非常好的研究对象,它控制着膜电位的变化进而影响神经元的兴奋性。研究团队从表观遗传学的角度,研究癫痫中离子通道和神经元兴奋性的变化机制。在本研究中,作者发现神经系统的兴奋性增强时,表观遗传因子CDYL表达量显著降低。当CDYL敲低时,小鼠/大鼠的癫痫发作潜伏期会明显缩短。其作用机制是当CDYL敲低时会导致海马体齿状回(DG)颗粒细胞的动作电位阈值明显降低,进而增加神经元兴奋性; 反之,当CDYL过表达时,神经元的兴奋性明显降低。通过ChIp-seq高通量测序发现,CDYL影响阈值的分子机制是抑制SCN8A的转录,导致轴突起始段(AIS) 钠离子通道Nav1.6表达降低。最后在颞叶癫痫病人的海马组织中发现CDYL的表达量明显降低,而SCN8A的表达量明显增加。该研究的意义在于从表观遗传学的角度来阐明癫痫的发生发展机制,并且从细胞分子层面解释了CDYL调节SCN8A的分子机制,为癫痫的药物研发提供了一个新的思路。
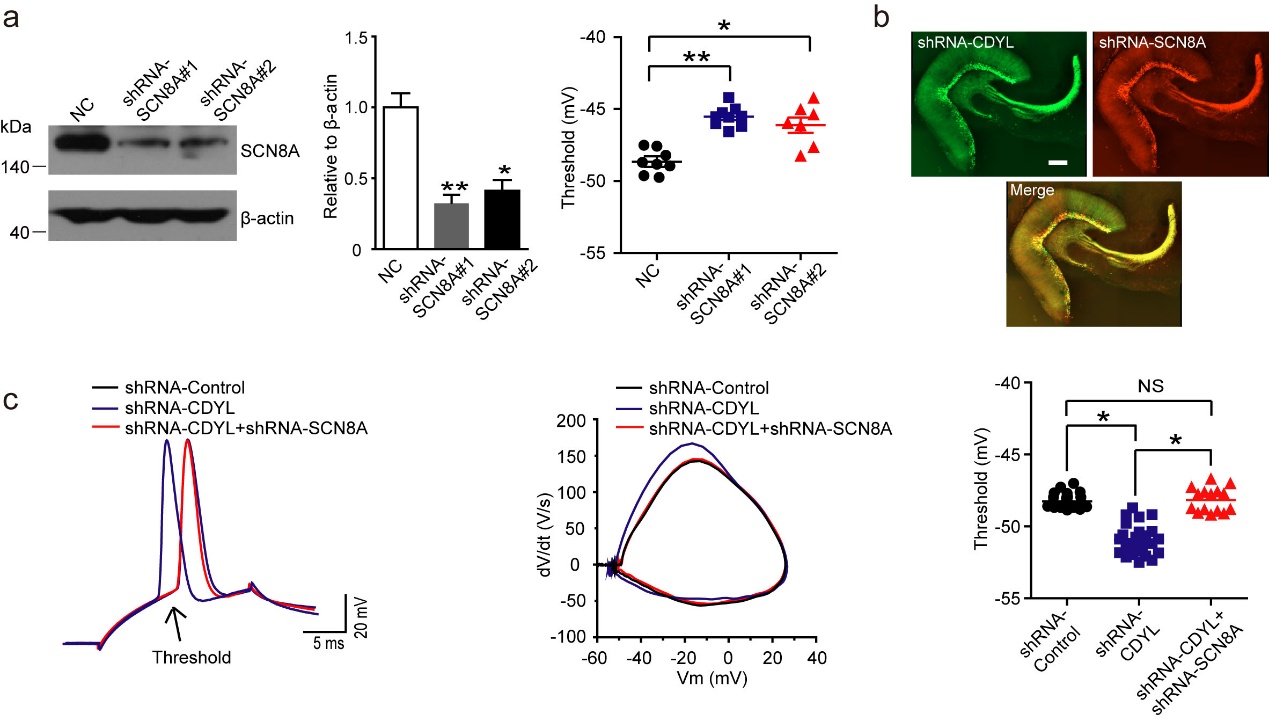
图二a. 蛋白免疫印迹显示海马齿状回颗粒细胞感染SCN8A-shRNA后,SCN8A表达量显著降低,两种病毒基本无差异,并且电流钳记录显示两种病毒感染后动作电位阈值相对对照组都显著增加。*p<0.05, **p<0.01,非配对双尾T检验。b. 两种慢病毒感染海马齿状回14天后的免疫荧光示意图。比例尺,200微米。c. 单个动作电位的示意图,以及动作电位统计图。三组海马齿状回颗粒细胞分别是感染慢病毒shRNA-Control,shRNA-CDYL以及同时感染shRNA-CDYL 和shRNA-SCN8A两种慢病毒。*p<0.05,单因素方差分析。
黄卓研究员和基础医学院的梁静副教授为本论文的共同通讯作者。该工作获得了国家自然科学基金(No. 81371432)和科技部973项目(No. 2015CB559200)的资助。
天然药物及仿生药物国家重点实验室






























