献礼百年校庆:药学院刘文教授团队连续发文在三阴性乳腺癌的免疫治疗方向取得重要进展
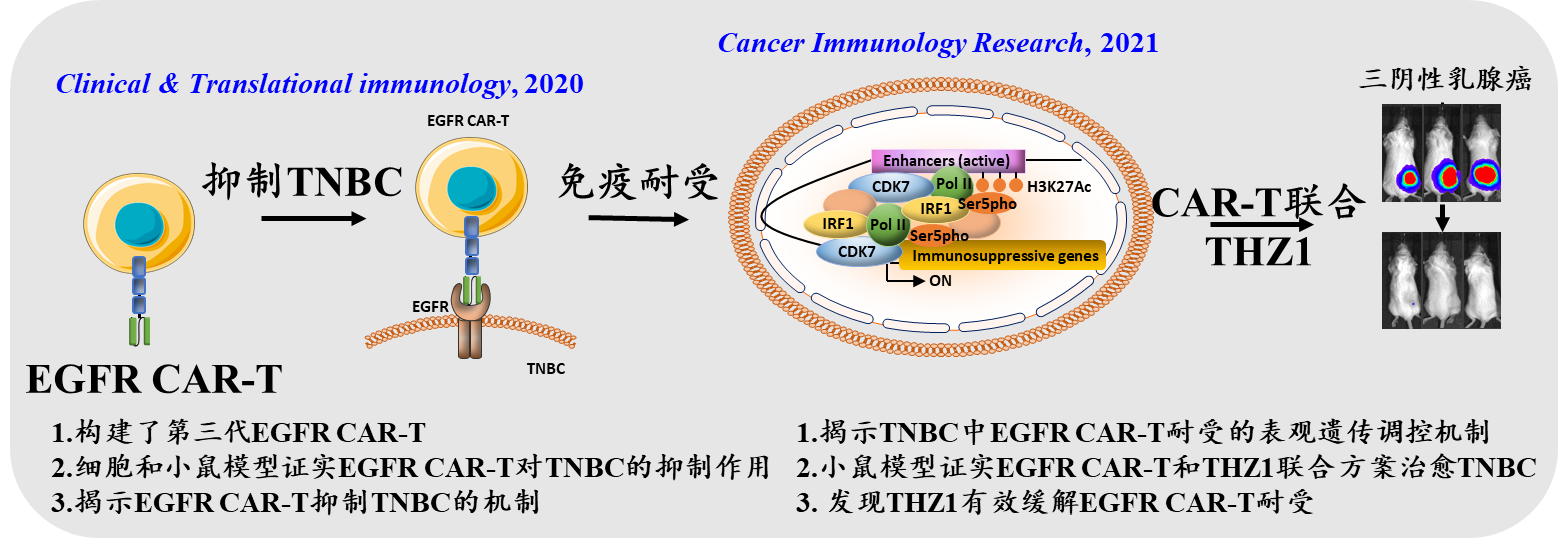
百年校庆之际,药学院刘文教授团队连续在Clinical & Translational Immunology和Cancer Immunology Research杂志上发表论文报道了一种靶向表皮生长因子受体(Epidermal growth factor receptor,EGFR)的新型嵌合抗原受体T细胞(CAR-T细胞)在小鼠肿瘤模型中能有效地抑制三阴性乳腺癌(Triple-negative breast cancer,TNBC),其与表观遗传调控因子CDK7抑制剂联合使用甚至达到治愈效果。
三阴性乳腺癌侵袭性强、复发快、预后差,临床上缺乏有效的治疗手段。包括CAR-T治疗在内的免疫治疗已经成为癌症治疗中极具前景的治疗方式之一。研究团队首先揭示了EGFR是三阴性乳腺癌中一个潜在的免疫治疗靶点,构建了一种靶向EGFR的新型CAR-T细胞(EGFR CAR-T),并在细胞和小鼠肿瘤模型中阐明了EGFR CAR-T细胞对三阴性乳腺癌的抑制作用和相关分子机制(Clinical & Translational Immunology,2020)。
和其它肿瘤治疗方法一样,随着治疗时间的延长, EGFR CAR-T细胞治疗的小鼠约三分之一发生了耐受的现象。因此,研究团队进一步致力于寻找克服耐受的方案。RNA-seq分析发现EGFR CAR-T会通过干扰素γ(INFγ)诱导一系列和免疫抑制相关的基因的表达;ChIp-seq分析揭示EGFR CAR-T激活的这些免疫抑制基因与邻近增强子的激活相关。于是,研究团队提出干预相关增强子的激活将有望干预免疫抑制基因的激活,从而克服免疫耐受。许多表观遗传调控因子被报道和增强子的激活密切相关。通过对一些靶向参与增强子激活的表观遗传调控因子的抑制剂的筛选发现CDK7的抑制剂THZ1能有效抑制相关增强子及其邻近免疫抑制基因的激活。相应地,THZ1与EGFR CAR-T细胞联合治疗的方案在多种三阴性乳腺癌小鼠模型中(包括人MDA-MB-231细胞来源的异种移植瘤模型,三阴性乳腺癌病人来源的异种移植瘤模型以及鼠EMT6细胞来源的移植瘤模型)能高效地抑制肿瘤的生长和转移,并且有些模型中实现了治愈的效果。最后,在已经产生耐受的肿瘤中,联合治疗也能有效缓解耐受(Cancer Immunology Research,2021)。
综上,研究团队构建了一种靶向EGFR的新型CAR-T细胞,证实了联合CAR-T肿瘤免疫治疗和表观遗传抑制剂能更有效抑制癌症的发生发展和缓解肿瘤免疫治疗引起的耐受,为临床上治疗三阴性乳腺癌提供了一种潜在的方式。
药学院刘文教授为文章的通讯作者,课题组助理教授夏琳、博士生郑早早、硕士生陈宇洁和公共卫生学院博士生刘珺懿为共同第一作者。该研究工作也得到了厦门大学公共卫生学院夏宁邵教授和罗文新教授,复旦大学附属肿瘤医院柳素玲教授,厦门大学药学院曾子晏教授的支持。该研究工作获得了科技部重点研发计划、国家自然科学基金项目、福建省自然科学基金项目、厦门市科技计划项目、厦门市科技重大专项、中央高校基本科研业务费专项资金等多个项目的经费支持。
论文链接: https://www.ncbi.nlm.nih.gov/pmc/articles/pMC7196685/;https://cancerimmunolres.aacrjournals.org/content/early/2021/04/19/2326-6066.CIR-20-0405.abstract






























