免疫治疗新兴靶点 I 清华大学药学院陈立功课题组应邀在国际知名学术期刊发表“溶质转运蛋白(SLCs)与肿瘤免疫治疗”
2021-12-02 00:00:00
来源:网络整理
近日,清华大学药学院陈立功研究组发表的综述文章系统总结了溶质转运蛋白(SLCs)所介导的三大营养物质(糖类、氨基酸类和脂类)对固有免疫和适应性免疫系统中代表性免疫细胞(T细胞、DC细胞、NK细胞和巨噬细胞)的代谢调控作用。同时,研究人员还提出了一些潜在的靶向免疫细胞上SLCs来增强肿瘤免疫治疗的策略。 人体分别利用消化系统和排泄系统来进行营养物质的摄入和代谢废物的排放,从而维持机体的正常运转和稳态,那么细胞的营养和代谢稳态又是通过什么来维持的呢?答案是:溶质转运蛋白和ABC转运蛋白。这是细胞膜上的两个转运蛋白超家族,其中SLCs转运蛋白主要介导各种溶质(如葡萄糖、氨基酸和脂类)的膜运输并维持细胞内环境稳定(如营养摄取、离子内流/外流和废物处理),而ABC转运蛋白主要通过利用ATp水解的能量发挥外排转运体的功能。SLCs在全身各个组织和器官都有不同程度的表达,且定位于细胞膜和多种亚细胞器膜上。SLCs包含65个家族,近400个成员。据报道,多达80%的小化学分子在功能上依赖于SLCs。此外,SLCs与多种人类疾病相关,如慢性疾病、精神障碍、心血管疾病和癌症。因此,SLCs家族是除G蛋白偶联受体、离子通道、核激素受体、催化受体和酶外的6大主要药理靶点之一。事实上,肿瘤微环境类似于淋巴器官,除肿瘤细胞外,还包含着各种类型的免疫细胞。无限增殖的肿瘤细胞和激活的免疫细胞都需要通过代谢重编程SLCs的表达来摄取足够的营养物质和维持内环境的稳态。近年来,越来越多的研究也表明SLCs在肿瘤免疫中发挥着重要的调控作用。2019年,陈立功课题组与医学院胡小玉课题组合作揭示SLC6A8转运蛋白介导肌酸调控巨噬细胞极化的新发现(Ji et al., Immunity 2019)。2020年,邹伟平课题组发现肿瘤通过SLC43A2来竞争T细胞的甲硫氨酸,从而影响T细胞的甲硫氨酸代谢和组蛋白甲基化修饰。同年,该课题组还发表了氨基酸及其转运体在T细胞免疫和癌症治疗的研究综述。此外,SLC7A11和SLC16A1/4等转运蛋白也已经被证实可以促进肿瘤的发生发展。因此,SLCs无论对免疫细胞还是肿瘤细胞来说,都十分重要,且可能平衡是肿瘤免疫治疗的一个重要支点。系统地总结三大营养物质(葡萄糖、氨基酸和脂质)相关的SLCs对不同免疫细胞的影响,可以引导我们更好地操控免疫代谢来增强肿瘤免疫治疗。肿瘤微环境中的免疫细胞不仅受到缺氧和酸化环境等的影响,通常还由于营养不足导致功能受损。因此,SLCs及其转运的底物(葡萄糖、氨基酸、脂质等)对于免疫细胞的存活和功能至关重要。T细胞表达葡萄糖相关转运蛋白(SLC2A1、SLC16A1/4),氨基酸相关转运蛋白(SLC7A5、SLC38A1、SLC43A2、SLC7A1等),脂质相关转运蛋白(FABp5、CpT1A等)以及一些其它类型的转运蛋白(SLC7A8、SLC36A4、SLC6A8和SLC6A13)并通过多种机制来影响其激活和功能(图1)。其中,糖类相关的SLCs主要涉及糖酵解、Akt/mTORC1信号通路、染色质乙酰化和IFN-γ生成等;氨基酸相关的SLCs主要包括mTORC1/c-Myc、TCR信号、糖酵解、氧化磷酸化、谷氨酰胺分解等;脂类相关的SLCs主要有TCR/CD28-mTORC1信号轴、脂肪酸氧化、ppARβ/γ信号通路等;以及与IDO1活性、AhR和pD-1表达、GABA-mTOR信号通路等相关的一些其它类型的转运蛋白。这些SLCs及其底物通过相似或不同的调控机制介导了T细胞不同亚型的激活和分化。因此,这就为我们利用SLCs来操控T细胞的功能和分化,从而提高肿瘤免疫治疗提供了可能。
人体分别利用消化系统和排泄系统来进行营养物质的摄入和代谢废物的排放,从而维持机体的正常运转和稳态,那么细胞的营养和代谢稳态又是通过什么来维持的呢?答案是:溶质转运蛋白和ABC转运蛋白。这是细胞膜上的两个转运蛋白超家族,其中SLCs转运蛋白主要介导各种溶质(如葡萄糖、氨基酸和脂类)的膜运输并维持细胞内环境稳定(如营养摄取、离子内流/外流和废物处理),而ABC转运蛋白主要通过利用ATp水解的能量发挥外排转运体的功能。SLCs在全身各个组织和器官都有不同程度的表达,且定位于细胞膜和多种亚细胞器膜上。SLCs包含65个家族,近400个成员。据报道,多达80%的小化学分子在功能上依赖于SLCs。此外,SLCs与多种人类疾病相关,如慢性疾病、精神障碍、心血管疾病和癌症。因此,SLCs家族是除G蛋白偶联受体、离子通道、核激素受体、催化受体和酶外的6大主要药理靶点之一。事实上,肿瘤微环境类似于淋巴器官,除肿瘤细胞外,还包含着各种类型的免疫细胞。无限增殖的肿瘤细胞和激活的免疫细胞都需要通过代谢重编程SLCs的表达来摄取足够的营养物质和维持内环境的稳态。近年来,越来越多的研究也表明SLCs在肿瘤免疫中发挥着重要的调控作用。2019年,陈立功课题组与医学院胡小玉课题组合作揭示SLC6A8转运蛋白介导肌酸调控巨噬细胞极化的新发现(Ji et al., Immunity 2019)。2020年,邹伟平课题组发现肿瘤通过SLC43A2来竞争T细胞的甲硫氨酸,从而影响T细胞的甲硫氨酸代谢和组蛋白甲基化修饰。同年,该课题组还发表了氨基酸及其转运体在T细胞免疫和癌症治疗的研究综述。此外,SLC7A11和SLC16A1/4等转运蛋白也已经被证实可以促进肿瘤的发生发展。因此,SLCs无论对免疫细胞还是肿瘤细胞来说,都十分重要,且可能平衡是肿瘤免疫治疗的一个重要支点。系统地总结三大营养物质(葡萄糖、氨基酸和脂质)相关的SLCs对不同免疫细胞的影响,可以引导我们更好地操控免疫代谢来增强肿瘤免疫治疗。肿瘤微环境中的免疫细胞不仅受到缺氧和酸化环境等的影响,通常还由于营养不足导致功能受损。因此,SLCs及其转运的底物(葡萄糖、氨基酸、脂质等)对于免疫细胞的存活和功能至关重要。T细胞表达葡萄糖相关转运蛋白(SLC2A1、SLC16A1/4),氨基酸相关转运蛋白(SLC7A5、SLC38A1、SLC43A2、SLC7A1等),脂质相关转运蛋白(FABp5、CpT1A等)以及一些其它类型的转运蛋白(SLC7A8、SLC36A4、SLC6A8和SLC6A13)并通过多种机制来影响其激活和功能(图1)。其中,糖类相关的SLCs主要涉及糖酵解、Akt/mTORC1信号通路、染色质乙酰化和IFN-γ生成等;氨基酸相关的SLCs主要包括mTORC1/c-Myc、TCR信号、糖酵解、氧化磷酸化、谷氨酰胺分解等;脂类相关的SLCs主要有TCR/CD28-mTORC1信号轴、脂肪酸氧化、ppARβ/γ信号通路等;以及与IDO1活性、AhR和pD-1表达、GABA-mTOR信号通路等相关的一些其它类型的转运蛋白。这些SLCs及其底物通过相似或不同的调控机制介导了T细胞不同亚型的激活和分化。因此,这就为我们利用SLCs来操控T细胞的功能和分化,从而提高肿瘤免疫治疗提供了可能。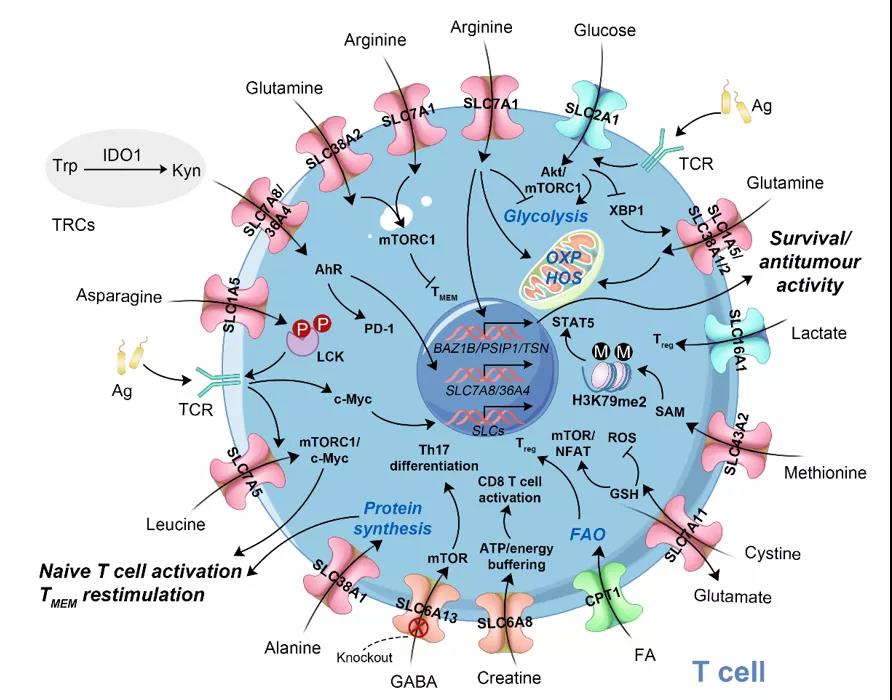 图1 T细胞上代表性的SLCs类似地,在DC细胞(图2)、NK细胞和巨噬细胞中,不同的SLCs也通过其转运的底物或者本身作为某一功能模块影响着免疫细胞多种生物学过程和事件。本综述通过分析和总结,系统地浮现了最新有关SLCs在这些免疫细胞中的深层调控规律,并试图利用这些发现通过联合靶向多种免疫细胞上具有潜力的SLCs来增强整体抗肿瘤免疫反应,最终为现有的免疫疗法或设计下一代免疫疗法提供一些新的思路。
图1 T细胞上代表性的SLCs类似地,在DC细胞(图2)、NK细胞和巨噬细胞中,不同的SLCs也通过其转运的底物或者本身作为某一功能模块影响着免疫细胞多种生物学过程和事件。本综述通过分析和总结,系统地浮现了最新有关SLCs在这些免疫细胞中的深层调控规律,并试图利用这些发现通过联合靶向多种免疫细胞上具有潜力的SLCs来增强整体抗肿瘤免疫反应,最终为现有的免疫疗法或设计下一代免疫疗法提供一些新的思路。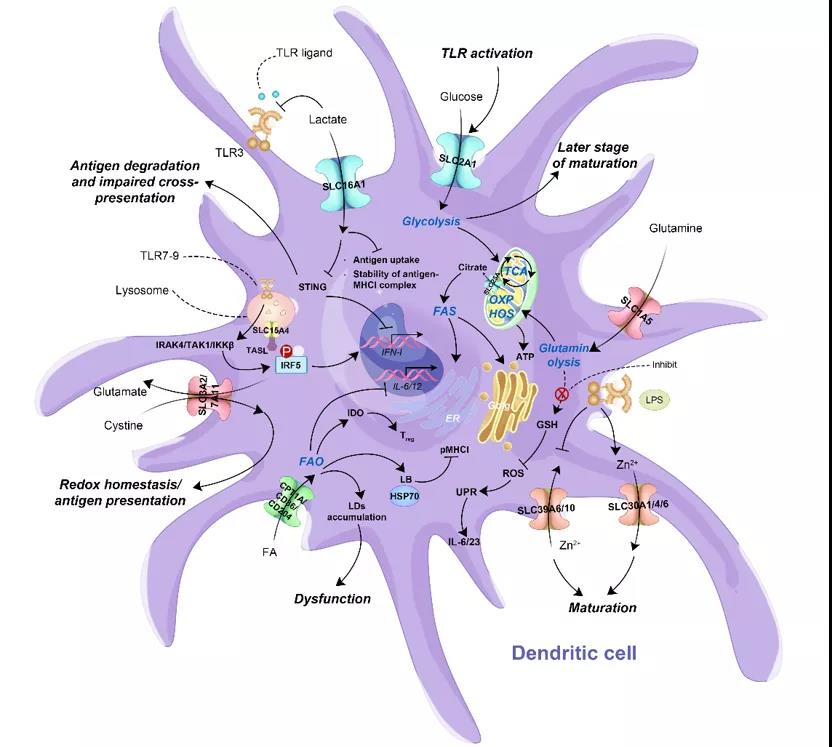 图2 DC细胞上代表性的SLCs现有的免疫疗法大都集中在增强某一类免疫细胞的功能来提高疗效,这些方法都取得了不错的效果,但都无法很好地激活机体整体的免疫反应来对抗肿瘤。SLCs作为肿瘤和免疫细胞都表达且对生存起至关重要的靶点,启发我们通过联合靶向肿瘤微环境中多种免疫细胞(T细胞、DC细胞、NK细胞和巨噬细胞)上相同或不同的SLCs来更好地增强免疫细胞的功能(如:抗原递呈,细胞因子、趋化因子和颗粒酶的分泌)和动员免疫细胞之间的相互作用(如:刺激、激活和招募),从而协同增强肿瘤免疫治疗(图3)。此外,鉴于大多数的肿瘤细胞也表达SLCs,因此,靶向免疫细胞上的SLCs开发下一代免疫疗法时,也应该将肿瘤细胞上的SLCs靶点考虑其中。
图2 DC细胞上代表性的SLCs现有的免疫疗法大都集中在增强某一类免疫细胞的功能来提高疗效,这些方法都取得了不错的效果,但都无法很好地激活机体整体的免疫反应来对抗肿瘤。SLCs作为肿瘤和免疫细胞都表达且对生存起至关重要的靶点,启发我们通过联合靶向肿瘤微环境中多种免疫细胞(T细胞、DC细胞、NK细胞和巨噬细胞)上相同或不同的SLCs来更好地增强免疫细胞的功能(如:抗原递呈,细胞因子、趋化因子和颗粒酶的分泌)和动员免疫细胞之间的相互作用(如:刺激、激活和招募),从而协同增强肿瘤免疫治疗(图3)。此外,鉴于大多数的肿瘤细胞也表达SLCs,因此,靶向免疫细胞上的SLCs开发下一代免疫疗法时,也应该将肿瘤细胞上的SLCs靶点考虑其中。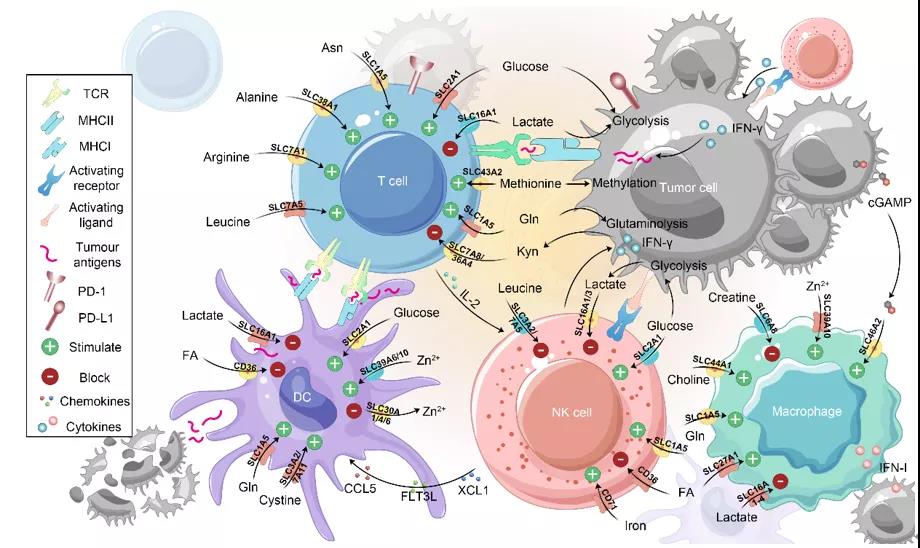 图3 联合靶向多种免疫细胞上的SLCs来增强肿瘤免疫治疗以上文章于2021年9月10日应邀在国际知名学术期刊《细胞生物学进展》(Trends in Cell Biology)发表,论文标题为《溶质转运蛋白:肿瘤免疫治疗的新兴中心角色》(Solute Carrier Transporters: Emerging Central players in Tumour Immunotherapy)。清华大学药学院陈立功研究员为本文通讯作者,其研究组2019级药学院博士研究生陈瑞群为本文第一作者。本研究得到了国家科技部重点研发计划项目(2018YFA0506903)、国家自然科学基金重点项目(91857108, 32130048, 81470839)、国家科技重大专项新药创新与开发项目(2018ZX09711003-004-002)的资助。原文链接:https://www.sciencedirect.com/science/article/pii/S096289242100163X?dgcid=author
图3 联合靶向多种免疫细胞上的SLCs来增强肿瘤免疫治疗以上文章于2021年9月10日应邀在国际知名学术期刊《细胞生物学进展》(Trends in Cell Biology)发表,论文标题为《溶质转运蛋白:肿瘤免疫治疗的新兴中心角色》(Solute Carrier Transporters: Emerging Central players in Tumour Immunotherapy)。清华大学药学院陈立功研究员为本文通讯作者,其研究组2019级药学院博士研究生陈瑞群为本文第一作者。本研究得到了国家科技部重点研发计划项目(2018YFA0506903)、国家自然科学基金重点项目(91857108, 32130048, 81470839)、国家科技重大专项新药创新与开发项目(2018ZX09711003-004-002)的资助。原文链接:https://www.sciencedirect.com/science/article/pii/S096289242100163X?dgcid=author
 人体分别利用消化系统和排泄系统来进行营养物质的摄入和代谢废物的排放,从而维持机体的正常运转和稳态,那么细胞的营养和代谢稳态又是通过什么来维持的呢?答案是:溶质转运蛋白和ABC转运蛋白。这是细胞膜上的两个转运蛋白超家族,其中SLCs转运蛋白主要介导各种溶质(如葡萄糖、氨基酸和脂类)的膜运输并维持细胞内环境稳定(如营养摄取、离子内流/外流和废物处理),而ABC转运蛋白主要通过利用ATp水解的能量发挥外排转运体的功能。SLCs在全身各个组织和器官都有不同程度的表达,且定位于细胞膜和多种亚细胞器膜上。SLCs包含65个家族,近400个成员。据报道,多达80%的小化学分子在功能上依赖于SLCs。此外,SLCs与多种人类疾病相关,如慢性疾病、精神障碍、心血管疾病和癌症。因此,SLCs家族是除G蛋白偶联受体、离子通道、核激素受体、催化受体和酶外的6大主要药理靶点之一。事实上,肿瘤微环境类似于淋巴器官,除肿瘤细胞外,还包含着各种类型的免疫细胞。无限增殖的肿瘤细胞和激活的免疫细胞都需要通过代谢重编程SLCs的表达来摄取足够的营养物质和维持内环境的稳态。近年来,越来越多的研究也表明SLCs在肿瘤免疫中发挥着重要的调控作用。2019年,陈立功课题组与医学院胡小玉课题组合作揭示SLC6A8转运蛋白介导肌酸调控巨噬细胞极化的新发现(Ji et al., Immunity 2019)。2020年,邹伟平课题组发现肿瘤通过SLC43A2来竞争T细胞的甲硫氨酸,从而影响T细胞的甲硫氨酸代谢和组蛋白甲基化修饰。同年,该课题组还发表了氨基酸及其转运体在T细胞免疫和癌症治疗的研究综述。此外,SLC7A11和SLC16A1/4等转运蛋白也已经被证实可以促进肿瘤的发生发展。因此,SLCs无论对免疫细胞还是肿瘤细胞来说,都十分重要,且可能平衡是肿瘤免疫治疗的一个重要支点。系统地总结三大营养物质(葡萄糖、氨基酸和脂质)相关的SLCs对不同免疫细胞的影响,可以引导我们更好地操控免疫代谢来增强肿瘤免疫治疗。肿瘤微环境中的免疫细胞不仅受到缺氧和酸化环境等的影响,通常还由于营养不足导致功能受损。因此,SLCs及其转运的底物(葡萄糖、氨基酸、脂质等)对于免疫细胞的存活和功能至关重要。T细胞表达葡萄糖相关转运蛋白(SLC2A1、SLC16A1/4),氨基酸相关转运蛋白(SLC7A5、SLC38A1、SLC43A2、SLC7A1等),脂质相关转运蛋白(FABp5、CpT1A等)以及一些其它类型的转运蛋白(SLC7A8、SLC36A4、SLC6A8和SLC6A13)并通过多种机制来影响其激活和功能(图1)。其中,糖类相关的SLCs主要涉及糖酵解、Akt/mTORC1信号通路、染色质乙酰化和IFN-γ生成等;氨基酸相关的SLCs主要包括mTORC1/c-Myc、TCR信号、糖酵解、氧化磷酸化、谷氨酰胺分解等;脂类相关的SLCs主要有TCR/CD28-mTORC1信号轴、脂肪酸氧化、ppARβ/γ信号通路等;以及与IDO1活性、AhR和pD-1表达、GABA-mTOR信号通路等相关的一些其它类型的转运蛋白。这些SLCs及其底物通过相似或不同的调控机制介导了T细胞不同亚型的激活和分化。因此,这就为我们利用SLCs来操控T细胞的功能和分化,从而提高肿瘤免疫治疗提供了可能。
人体分别利用消化系统和排泄系统来进行营养物质的摄入和代谢废物的排放,从而维持机体的正常运转和稳态,那么细胞的营养和代谢稳态又是通过什么来维持的呢?答案是:溶质转运蛋白和ABC转运蛋白。这是细胞膜上的两个转运蛋白超家族,其中SLCs转运蛋白主要介导各种溶质(如葡萄糖、氨基酸和脂类)的膜运输并维持细胞内环境稳定(如营养摄取、离子内流/外流和废物处理),而ABC转运蛋白主要通过利用ATp水解的能量发挥外排转运体的功能。SLCs在全身各个组织和器官都有不同程度的表达,且定位于细胞膜和多种亚细胞器膜上。SLCs包含65个家族,近400个成员。据报道,多达80%的小化学分子在功能上依赖于SLCs。此外,SLCs与多种人类疾病相关,如慢性疾病、精神障碍、心血管疾病和癌症。因此,SLCs家族是除G蛋白偶联受体、离子通道、核激素受体、催化受体和酶外的6大主要药理靶点之一。事实上,肿瘤微环境类似于淋巴器官,除肿瘤细胞外,还包含着各种类型的免疫细胞。无限增殖的肿瘤细胞和激活的免疫细胞都需要通过代谢重编程SLCs的表达来摄取足够的营养物质和维持内环境的稳态。近年来,越来越多的研究也表明SLCs在肿瘤免疫中发挥着重要的调控作用。2019年,陈立功课题组与医学院胡小玉课题组合作揭示SLC6A8转运蛋白介导肌酸调控巨噬细胞极化的新发现(Ji et al., Immunity 2019)。2020年,邹伟平课题组发现肿瘤通过SLC43A2来竞争T细胞的甲硫氨酸,从而影响T细胞的甲硫氨酸代谢和组蛋白甲基化修饰。同年,该课题组还发表了氨基酸及其转运体在T细胞免疫和癌症治疗的研究综述。此外,SLC7A11和SLC16A1/4等转运蛋白也已经被证实可以促进肿瘤的发生发展。因此,SLCs无论对免疫细胞还是肿瘤细胞来说,都十分重要,且可能平衡是肿瘤免疫治疗的一个重要支点。系统地总结三大营养物质(葡萄糖、氨基酸和脂质)相关的SLCs对不同免疫细胞的影响,可以引导我们更好地操控免疫代谢来增强肿瘤免疫治疗。肿瘤微环境中的免疫细胞不仅受到缺氧和酸化环境等的影响,通常还由于营养不足导致功能受损。因此,SLCs及其转运的底物(葡萄糖、氨基酸、脂质等)对于免疫细胞的存活和功能至关重要。T细胞表达葡萄糖相关转运蛋白(SLC2A1、SLC16A1/4),氨基酸相关转运蛋白(SLC7A5、SLC38A1、SLC43A2、SLC7A1等),脂质相关转运蛋白(FABp5、CpT1A等)以及一些其它类型的转运蛋白(SLC7A8、SLC36A4、SLC6A8和SLC6A13)并通过多种机制来影响其激活和功能(图1)。其中,糖类相关的SLCs主要涉及糖酵解、Akt/mTORC1信号通路、染色质乙酰化和IFN-γ生成等;氨基酸相关的SLCs主要包括mTORC1/c-Myc、TCR信号、糖酵解、氧化磷酸化、谷氨酰胺分解等;脂类相关的SLCs主要有TCR/CD28-mTORC1信号轴、脂肪酸氧化、ppARβ/γ信号通路等;以及与IDO1活性、AhR和pD-1表达、GABA-mTOR信号通路等相关的一些其它类型的转运蛋白。这些SLCs及其底物通过相似或不同的调控机制介导了T细胞不同亚型的激活和分化。因此,这就为我们利用SLCs来操控T细胞的功能和分化,从而提高肿瘤免疫治疗提供了可能。 图1 T细胞上代表性的SLCs类似地,在DC细胞(图2)、NK细胞和巨噬细胞中,不同的SLCs也通过其转运的底物或者本身作为某一功能模块影响着免疫细胞多种生物学过程和事件。本综述通过分析和总结,系统地浮现了最新有关SLCs在这些免疫细胞中的深层调控规律,并试图利用这些发现通过联合靶向多种免疫细胞上具有潜力的SLCs来增强整体抗肿瘤免疫反应,最终为现有的免疫疗法或设计下一代免疫疗法提供一些新的思路。
图1 T细胞上代表性的SLCs类似地,在DC细胞(图2)、NK细胞和巨噬细胞中,不同的SLCs也通过其转运的底物或者本身作为某一功能模块影响着免疫细胞多种生物学过程和事件。本综述通过分析和总结,系统地浮现了最新有关SLCs在这些免疫细胞中的深层调控规律,并试图利用这些发现通过联合靶向多种免疫细胞上具有潜力的SLCs来增强整体抗肿瘤免疫反应,最终为现有的免疫疗法或设计下一代免疫疗法提供一些新的思路。 图2 DC细胞上代表性的SLCs现有的免疫疗法大都集中在增强某一类免疫细胞的功能来提高疗效,这些方法都取得了不错的效果,但都无法很好地激活机体整体的免疫反应来对抗肿瘤。SLCs作为肿瘤和免疫细胞都表达且对生存起至关重要的靶点,启发我们通过联合靶向肿瘤微环境中多种免疫细胞(T细胞、DC细胞、NK细胞和巨噬细胞)上相同或不同的SLCs来更好地增强免疫细胞的功能(如:抗原递呈,细胞因子、趋化因子和颗粒酶的分泌)和动员免疫细胞之间的相互作用(如:刺激、激活和招募),从而协同增强肿瘤免疫治疗(图3)。此外,鉴于大多数的肿瘤细胞也表达SLCs,因此,靶向免疫细胞上的SLCs开发下一代免疫疗法时,也应该将肿瘤细胞上的SLCs靶点考虑其中。
图2 DC细胞上代表性的SLCs现有的免疫疗法大都集中在增强某一类免疫细胞的功能来提高疗效,这些方法都取得了不错的效果,但都无法很好地激活机体整体的免疫反应来对抗肿瘤。SLCs作为肿瘤和免疫细胞都表达且对生存起至关重要的靶点,启发我们通过联合靶向肿瘤微环境中多种免疫细胞(T细胞、DC细胞、NK细胞和巨噬细胞)上相同或不同的SLCs来更好地增强免疫细胞的功能(如:抗原递呈,细胞因子、趋化因子和颗粒酶的分泌)和动员免疫细胞之间的相互作用(如:刺激、激活和招募),从而协同增强肿瘤免疫治疗(图3)。此外,鉴于大多数的肿瘤细胞也表达SLCs,因此,靶向免疫细胞上的SLCs开发下一代免疫疗法时,也应该将肿瘤细胞上的SLCs靶点考虑其中。 图3 联合靶向多种免疫细胞上的SLCs来增强肿瘤免疫治疗以上文章于2021年9月10日应邀在国际知名学术期刊《细胞生物学进展》(Trends in Cell Biology)发表,论文标题为《溶质转运蛋白:肿瘤免疫治疗的新兴中心角色》(Solute Carrier Transporters: Emerging Central players in Tumour Immunotherapy)。清华大学药学院陈立功研究员为本文通讯作者,其研究组2019级药学院博士研究生陈瑞群为本文第一作者。本研究得到了国家科技部重点研发计划项目(2018YFA0506903)、国家自然科学基金重点项目(91857108, 32130048, 81470839)、国家科技重大专项新药创新与开发项目(2018ZX09711003-004-002)的资助。原文链接:https://www.sciencedirect.com/science/article/pii/S096289242100163X?dgcid=author
图3 联合靶向多种免疫细胞上的SLCs来增强肿瘤免疫治疗以上文章于2021年9月10日应邀在国际知名学术期刊《细胞生物学进展》(Trends in Cell Biology)发表,论文标题为《溶质转运蛋白:肿瘤免疫治疗的新兴中心角色》(Solute Carrier Transporters: Emerging Central players in Tumour Immunotherapy)。清华大学药学院陈立功研究员为本文通讯作者,其研究组2019级药学院博士研究生陈瑞群为本文第一作者。本研究得到了国家科技部重点研发计划项目(2018YFA0506903)、国家自然科学基金重点项目(91857108, 32130048, 81470839)、国家科技重大专项新药创新与开发项目(2018ZX09711003-004-002)的资助。原文链接:https://www.sciencedirect.com/science/article/pii/S096289242100163X?dgcid=author 





























