张炜佳课题组《eLife》报道线粒体动力学调节胸主动脉瘤发生发展
胸主动脉瘤和胸主动脉夹层(Thoracic Aortic Aneurysm and Aortic Dissection,TAAD)是致死率最高的心血管疾病。其发展到一定程度可发生急性破裂,引起难以控制的大出血致病人死亡。二叶式主动脉瓣(Bicuspid Aortic Valve,BAV)畸形在人群中的总体发病率为1-2%,BAV患者并发主动脉扩张病变的风险极高,是TAAD的独立危险因素。BAV及TAAD的治疗以手术为主,救治过程对于医院设施以及医务人员的专业技术,包括心血管外科、麻醉科、体外循环、重症监护科的团队协同能力要求极高。因此,及早筛选出高危患者,在发生主动脉夹层前进行预防性手术治疗和早期药物控制,是最重要和最有效的救治策略。
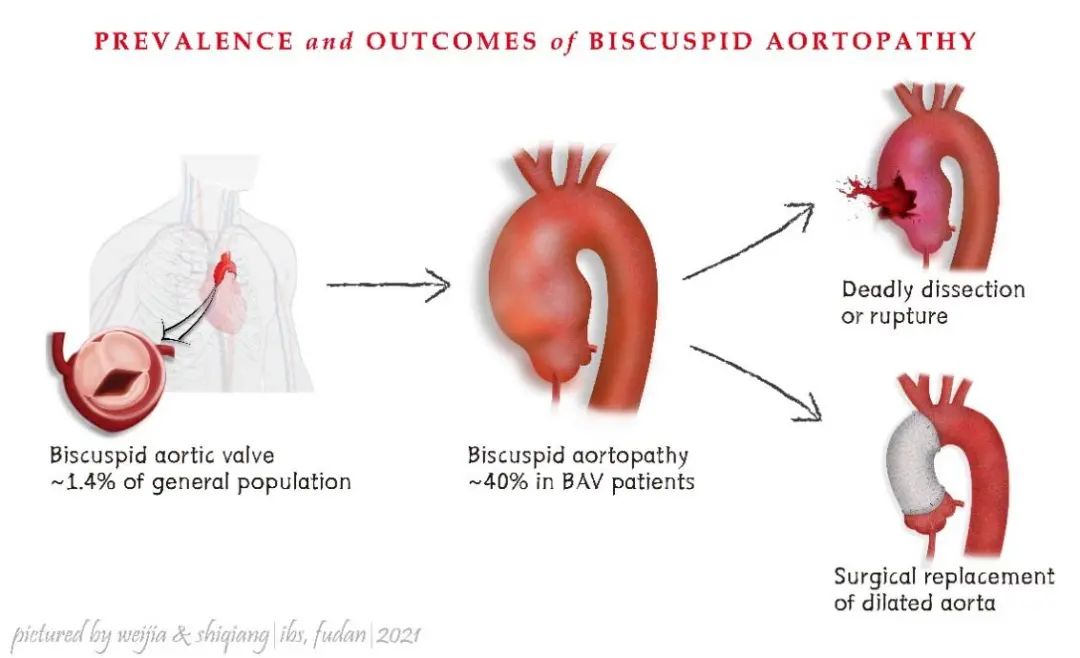
随着研究深入,医学工作者逐渐认识到BAV是一种可遗传的疾病,其中10-35%的一级亲属以常染色体显性方式受到影响。其中,NOTCH1基因是通过全基因组分析鉴定得到的第一个、也是发生比例最高的基因。然而,目前仍然缺乏有效药物可以控制该疾病的进程。
2021年9月6日,我院张炜佳团队与中山医院王春生/朱铠团队合作,在eLife发表了题为Aorta smooth muscle-on-a-chip reveals impaired mitochondrial dynamics as a therapeutic target for aortic aneurysm in bicuspid aortic valve disease的研究性文章。同时,该论文被遴选为“eLife digest”科学文摘评述报道。该研究揭示了在心率周期性张应力下,主动脉平滑肌细胞NOTCH1表达不足加剧线粒体分裂―融合平衡往分裂状态转移,进而促进细胞损伤及凋亡,最终引起主动脉血管扩张病变的过程。此外,还验证和探讨了靶向线粒体融合-分裂失衡的“老药”用于新适应症的可行性。

该研究首先对升主动脉置换术中获取的患者组织进行病理、蛋白组等分析,发现了NOTCH1和线粒体融合蛋白的表达同步下降的现象,以及患者主动脉平滑肌细胞存在线粒体功能失衡的特征。
由于BAV及TAAD疾病动物模型的外显率低,造成了体内实验模型的匮乏,因此作者们设计了体外微生理模型(器官芯片)的实验模型,利用疾病原代人主动脉平滑肌细胞,进一步确认了NOTCH1调节血管平滑肌细胞的表型改变和线粒体分裂―融合平衡的功能。最后,使用DRp1抑制剂和MFN1/2激活剂,验证了其对于逆转血管平滑肌细胞线粒体失衡和表型变化的作用,探讨靶向线粒体融合-分裂失衡的来氟米特等FDA已批准上市的药物用于治疗BAV及TAAD的可能性。
近年来,陆续有研究报道线粒体动力学失衡的因素对于诸多严重心血管疾病发生发展的影响,如缺血再灌注损伤、肺动脉高压等。此项研究揭示了血管平滑肌细胞的线粒体动力学以及线粒体功能在主动脉疾病中的重要作用,为临床治疗提供了新的思路。该研究仍存在一些不足,主要是缺乏可靠的动物模型因而缺少体内实验数据的支持,同时这也是未来开展临床实验前亟需解决的棘手问题。
复旦大学附属中山医院心外科2017级博士生米尔阿迪力江·阿布都帕塔尔(现为中山医院外科基地住院医师)为第一作者,复旦大学附属中山医院王春生、朱铠,复旦大学生物医学研究院张炜佳为通讯作者。复旦大学王丽、晏国全、李军、赖颢等老师与同学为本研究做出了积极贡献。本研究过程中得到复旦大学蓝斐、余发星、叶丹、丁建东等教授的科学指导和建议。特别鸣谢中国质谱与蛋白质组学先驱科学家杨芃原教授(1949.6.12—2021.5.31)对于本文临床蛋白质组学部分的研究策略的指导。
原文链接:
https://elifesciences.org/articles/69310






























