林杰课题组揭示基因表达随细胞体积增大呈现非线性变化的机制
为了保证正常的生理活动,细胞需要保持蛋白质和其他功能分子浓度保持在一个较为恒定的水平。的确,对于大部分蛋白质和mRNA,在细胞的生长过程中,它们的数量与细胞体积呈线性关系,因此它们的浓度基本保持恒定。然而,总存在一些基因产物表现出非恒定的浓度,也就是说它们的数量与细胞体积呈现超线性(superlinear)或亚线性(sublinear)的关系。有趣的是,这些呈现非恒定浓度的蛋白质往往与细胞周期调控[1]和细胞衰老相关[2]。
为了探究基因非线性表达的生物物理机制,北京大学前沿交叉学科研究院、定量生物学中心/北大-清华生命科学联合中心的林杰课题组提出了一个新颖的全细胞尺度上的基因表达模型。通过数学推演,作者发现基因对RNA聚合酶不同的招募能力会使其产物浓度随着细胞体积增大而变化。招募能力强的基因,其产物浓度倾向于随着细胞变大而减小,而招募能力弱的基因,浓度倾向于随着细胞变大而增加。作者利用数值模拟和酵母细胞的实验数据[1]对该理论进行了验证。该工作于2021年11月25日发表于学术期刊《Nature Communications》,题目为 “Heterogeneous recruitment abilities to RNA polymerases generate nonlinear scaling of gene expression with cell volume”。链接:https://doi.org/10.1038/s41467-021-26952-y
作者引入了一个以米氏方程为基础的基因表达全细胞水平模型(图1)。该模型中,不同基因对RNA聚合酶 (RNAp) 存在相互竞争的关系。每一个基因的启动子都有一定概率吸附RNAp,不同基因对RNAp的招募能力取决于对应吸附概率中的米氏常数。实验上已经发现[3, 4],RNA聚合酶的数量往往是限制基因转录速率的主要因素。基于此假设,作者发现当某个基因的米氏常数大于(小于)平均米氏常数时,其mRNA和蛋白质表达量与细胞体积呈现超线性(亚线性)关系。该预测与数值模拟的结果非常匹配(图2)。随后作者利用酵母细胞的RNA测序数据[1],在RNA水平对该理论进行了验证(图3)。作者利用GSEA(Gene Set Enrichment Analysis)在亚线性表达的基因启动子区域中筛选到77个转录因子结合motif,且功能富集分析显示,对转录有促进功能的转录因子motif显著地富集在其中,进一步验证了该理论(图3)。
该工作对基因表达的动力学过程建立了新的数学模型,为解释生物分子浓度稳态调控、细胞周期调控、细胞大小调控、细胞的资源分配等生物学问题提供了新的思路。此外,该理论还可应用于合成生物学研究,指导基因表达元件的开发和使用,从而使基因回路的效果更加量化和可预测,乃至未来在工业生产中优化工程细胞的性能。
北京大学前沿交叉学科研究院,定量生物学中心博士生王琪润为第一作者, 北京大学前沿交叉学科研究院、定量生物学中心/北大-清华生命科学联合中心林杰为通讯作者。
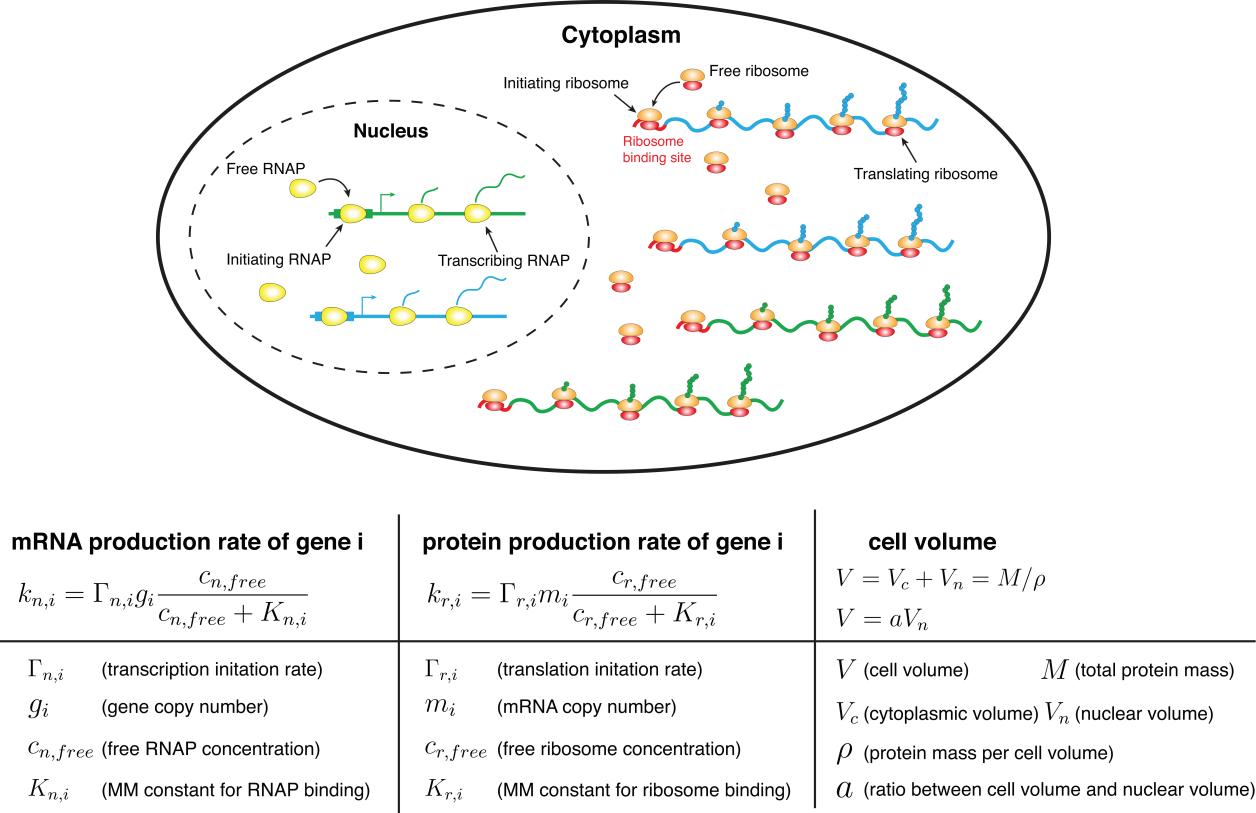
图1:基因表达的全细胞水平模型
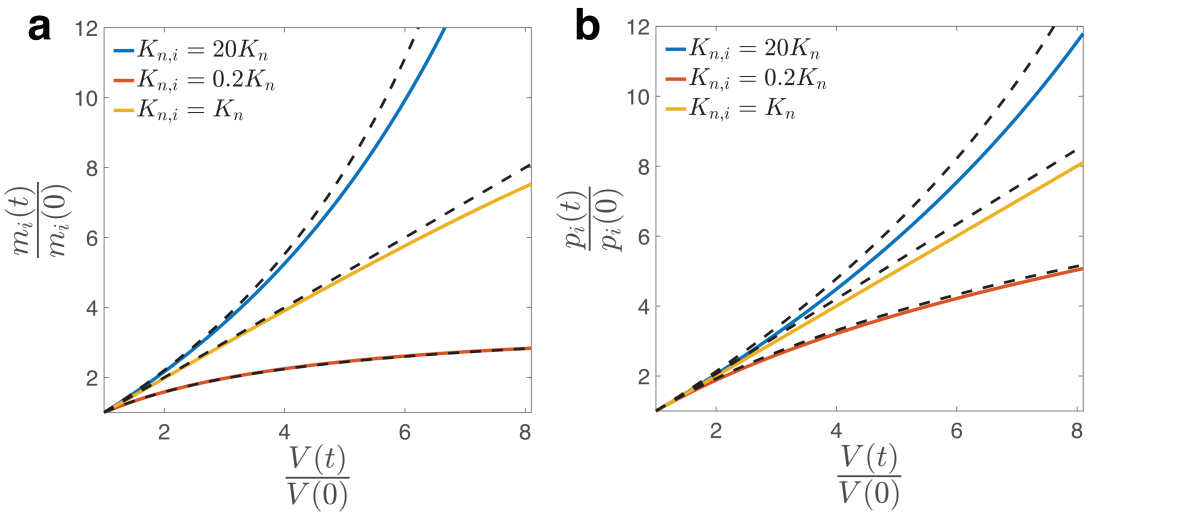
图2:数值模拟与理论预测
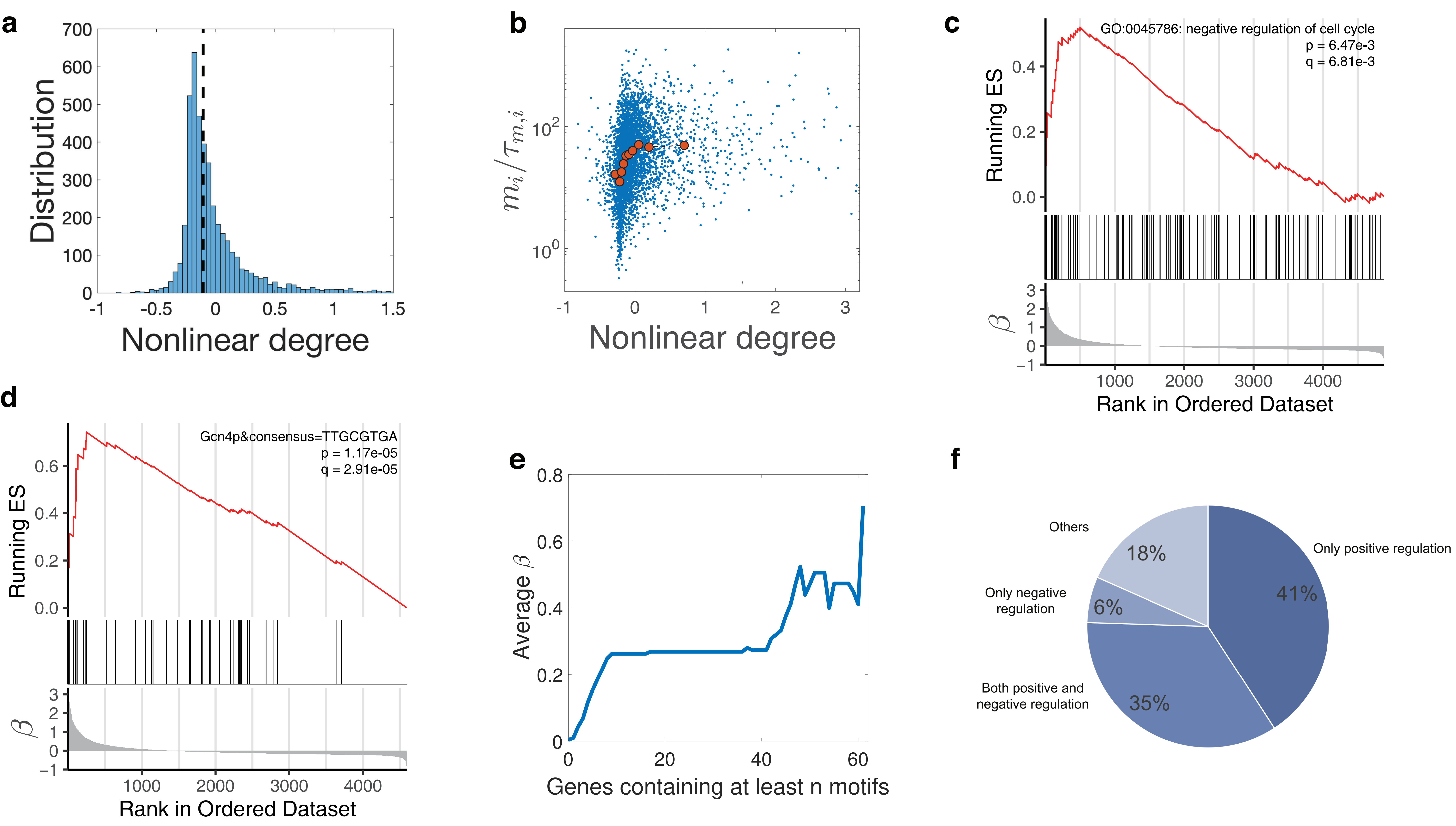
图3:实验验证
[1] Chen, Y., Zhao, G., Zahumensky, J., Honey, S. & Futcher, B. Differential scaling of gene expression with cell size may explain size control in budding yeast. Molecular Cell 78, 359 – 370.e6 (2020).
[2] Lanz, M. C. et al. Increasing cell size remodels the proteome and promotes senescence. bioRxiv (2021).
[3] Sun, X.-M. et al. Size-dependent increase in rna polymerase ii initiation rates mediates gene expression scaling with cell size. Curr. Biol. 30, 1217–1230.e7 (2020)
[4] Zhurinsky, J. et al. A coordinated global control over cellular transcription. Curr. Biol. 20, 2010–2015 (2010).






























