《Nature》PC-CAR免疫疗法彻底根除了小鼠体内的“儿童癌症之王”
以CAR-T为代表的癌症免疫治疗的发展带来了治愈白血病和其他血液系统癌症的希望,但这种方法在实体瘤治疗方面尚未取得实质性突破,部分原因是许多实体瘤缺乏肿瘤特异性性性靶点。
在这些癌症中,大多数负责肿瘤生长和存活的蛋白质深埋在细胞质甚至肿瘤细胞的细胞核中,而不是细胞表面。
神经母细胞瘤是儿童最常见的颅外实体瘤,也被称为儿童癌症之王。这类癌症几乎没有基因突变,但受表观遗传疾病的驱动,因此缺乏免疫治疗的靶点,并且通常在常规治疗(如放疗、化疗和手术)后复发。
2021年11月3日,美国费城儿童医院和英国伦敦大学学院的一个研究团队在《Nature》杂志上联合发表了一篇研究论文。
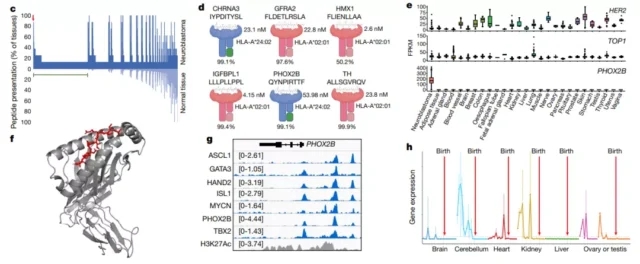
该研究使用了大量数据集和先进的算法来确定神经母细胞瘤免疫肽组富含对肿瘤发生至关重要的蛋白质肽,并重点研究了在未突变的QYNpIRTTF中发现的人类白细胞抗原(HLA)-A*24:02肽,该肽来源于神经母细胞瘤依赖性基因转录调节因子和pHOX2B的核心,可能是用于靶向治疗的“肽中心”嵌合抗原受体( the pC-the CAR)。
pC-CAR是一种新型的工程化T细胞,可以刺激免疫反应以根除体内肿瘤。这些发现为通过免疫疗法治疗更广泛的癌症打开了大门,并将每种疗法应用于更大比例的人群。
首先,研究团队对8种神经母细胞瘤细胞来源的异种移植物(CDX)和患者来源的异种移植物(pDX)进行了免疫肽组学测试,并使用三个公共数据集筛选和鉴定了来自神经母细胞瘤中表达的9个独特基因的13种肽。
然后,根据同样的方法,他们从8个高危神经母细胞瘤原发肿瘤中鉴定出56个肽。
为了选择那些具有最高潜力的肽作为假定的免疫治疗靶点,他们根据pMHC结合亲和力、HLA等位基因频率、亲本基因的差异表达程度以及MHC相对于其他肽的相对丰度对肽进行了优先排序,现已确定,pHOX2B是神经母细胞瘤的高度特异性肿瘤抗原,是治疗靶向的理想候选。
合成肽中心受体的使用可诱导免疫原性惰性pMCs产生免疫原性。同时,由于在多次筛查中未发现高亲和力T细胞受体(TCR),研究团队继续开发基于单链抗体的CAR,而不是pHOX2B的工程化TCR。
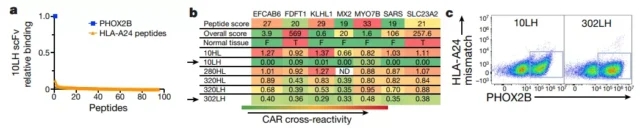
为了筛选pHOX2B肽特异性克隆,他们使用蛋白质显示平台ReD,该平台可以通过流式细胞术在渗透性细菌细胞中选择pMHC结合单链抗体。ReD产生了25种单链抗体结合物。
为了避免正常组织和pMHC之间的交叉反应,他们开发了一种称为sCRAp的算法来预测潜在的交叉反应,并鉴定出特异性最高的克隆10LH。
细胞实验证明了CRAp在预先识别非靶向效应、有效筛选其功能后果以及识别与肿瘤靶点具有高度选择性结合的分子方面的有效性。
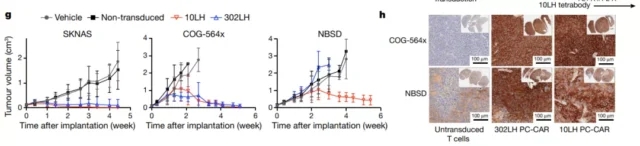
最后,研究小组使用皮下移植于免疫缺陷小鼠的神经母细胞瘤模型测试了10LH的靶向杀伤潜力。用10LH-转导的CAR-T细胞(10LH-pC-CAR)治疗的模型小鼠显示出完全的肿瘤反应。他们还观察到CAR治疗诱导肿瘤中MHC的大量上调。这种上调可能是由于有效的IFN-γ释放,表明该疗法可以在低抗原密度下激活T细胞,从而启动前馈级联反应,增加MHC和抗原呈递。
总结
本研究提出了一种从非突变癌蛋白中鉴定肿瘤特异性抗原的方法。为这些肿瘤自身肽构建以肽为中心的嵌合抗原受体(pC-CAR),可以有效刺激免疫系统,对神经母细胞瘤小鼠模型显示出良好的效果,彻底根除小鼠肿瘤。
这些发现表明,以肽为中心的CAR可以极大地扩展免疫治疗靶库,通过免疫治疗和将每种治疗应用于更大比例的人群,为更广泛的癌症治疗打开大门。
了解华大高通量的单细胞免疫组库测序技术>>
https://www.nature.com/articles/s41586-021-04061-6