Science子刊:环境+MEF2转录因子与老年人“认知弹性”有关
这些发现可能有助于解释为什么一些生活丰富的人不容易得阿尔茨海默氏症。
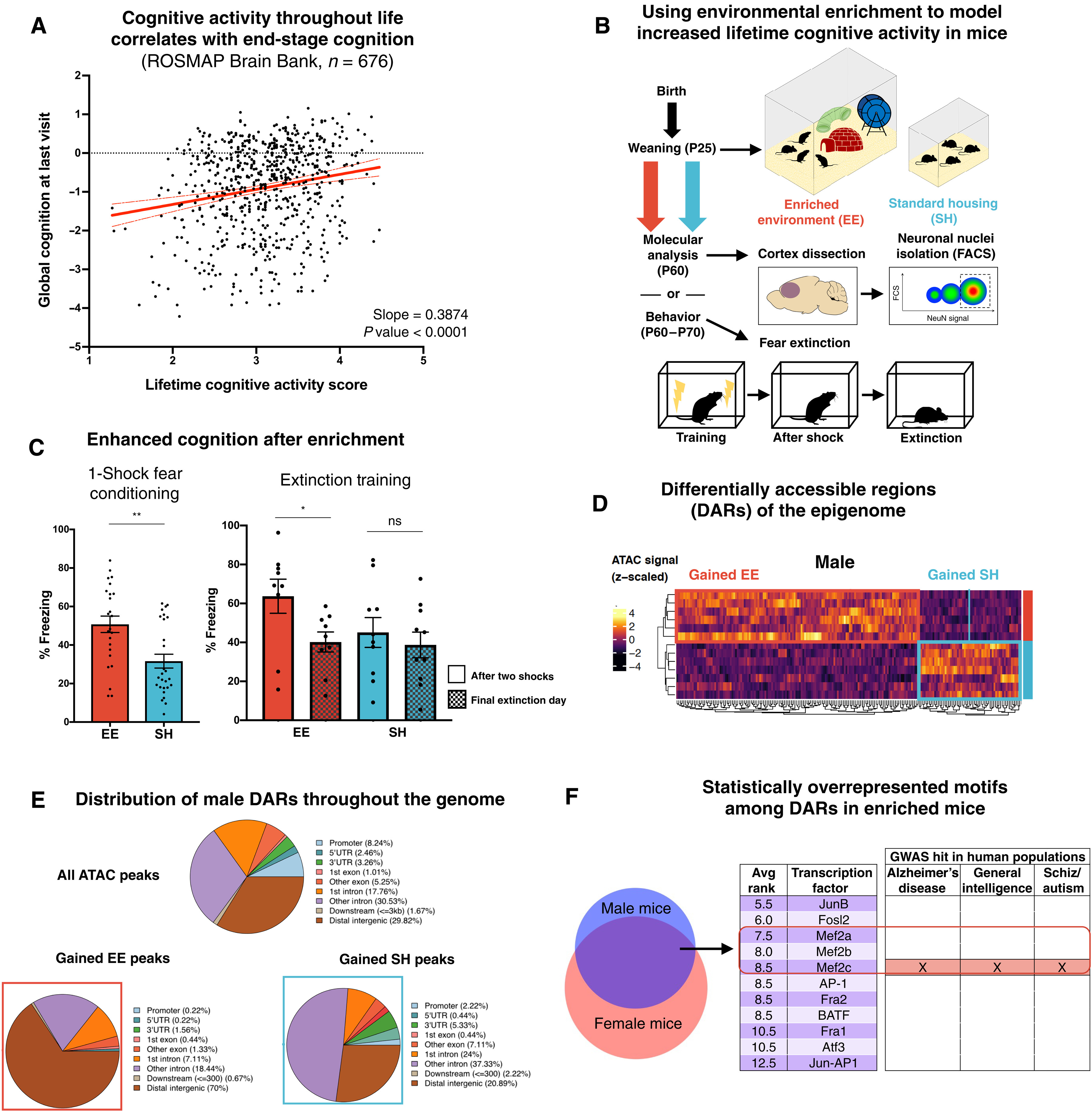
随着年龄的增长,许多人会患上阿尔茨海默氏症或其他形式的痴呆症。然而,即使他们的大脑显示出神经退化的潜在迹象,其他人在进入老年后仍然保持敏锐。
研究人员发现,在这些认知弹性强的人群中,教育水平和从事智力刺激活动的时间长短是有助于预防痴呆的因素。麻省理工学院(MIT)研究人员的一项新研究表明,这种环境似乎激活了一个名为MEF2的基因家族,该基因家族控制着大脑中促进抵抗认知能力下降的遗传程序。
研究人员在人类和小鼠身上观察到MEF2和认知弹性之间的这种联系。研究结果表明,增强MEF2或其靶点的活性可能有助于预防年龄相关性痴呆。
麻省理工学院(MIT)皮考尔学习与记忆研究所(picower Institute for Learning and Memory)所长Li-Huei Tsai表示:“人们越来越认识到,有一些弹性因素可以保护大脑功能。当我们考虑治疗干预或预防认知衰退和神经退化相关的痴呆症时,了解这种弹性机制可能会有所帮助。”
Tsai是该研究的资深作者,该研究于2021年11月3日发表在《Science Translational Medicine》杂志上。该研究的主要作者是最近获得麻省理工学院博士学位的Scarlett Barker和麻省理工学院博士后研究员、波士顿儿童医院医生Ravikiran (Ravi) Raju。
保护作用大量研究表明,环境刺激对神经退化有一定的保护作用。研究表明,教育水平、工作类型、使用语言的数量、阅读和做填字游戏等活动的时间长短,都与更高程度的认知弹性有关。
麻省理工学院的团队试图弄清楚这些环境因素是如何在神经元水平上影响大脑的。他们同时研究了人类数据集和小鼠模型,结果发现MEF2是一个关键因素。
MEF2是一种转录因子,最初被认为是心肌发育的重要因子,但后来被发现在神经元功能和神经发育中发挥作用。麻省理工学院的研究小组在两个总共1000多人的人类数据集中发现,认知弹性与MEF2及其调控的许多基因的表达高度相关。
利用芯片来检测表观基因组,领取Arraystar表观转录组芯片详细技术资料
这些基因中有许多编码离子通道,而离子通道控制着神经元的兴奋性,或神经元发出电脉冲的容易程度。研究人员还发现,通过对人类脑细胞的单细胞RNA测序研究,MEF2似乎在弹性个体的前额皮质的兴奋性神经元亚群中最活跃。
为了研究老鼠的认知弹性,研究人员将两组小鼠进行了比较,一组是在没有玩具的笼子里长大的,另一组是在更刺激的环境中长大的,笼子里有一个跑步轮,每隔几天就要换一次玩具。正如他们在人类研究中发现的那样,暴露在丰富环境中的小鼠大脑中的MEF2更加活跃。这些小鼠在学习和记忆任务中也表现得更好。
当研究人员敲除额叶皮层中的MEF2基因时,小鼠就无法从丰富的环境中受益,它们的神经元变得异常兴奋。
“这是特别令人兴奋的,因为它表明MEF2在决定对环境变量的反应的整体认知潜力中发挥了作用,”Raju说。
研究人员随后研究了MEF2是否可以逆转小鼠模型中认知障碍的一些症状,小鼠模型中表达了一种tau蛋白,这种蛋白可以在大脑中形成缠结,并与痴呆症有关。如果这些小鼠在年轻时被设计成过度表达MEF2,它们在晚年时就不会表现出tau蛋白通常产生的认知障碍。在这些小鼠中,过表达MEF2的神经元不那么兴奋。
“许多关于神经退化的人类研究和小鼠模型研究表明,在疾病进展的早期阶段,神经元变得过度兴奋,”Raju说。“当我们在神经退化的小鼠模型中过度表达MEF2时,我们看到它能够防止这种过度兴奋,这可能解释了为什么它们的认知表现比对照组小鼠更好。”
提高韧性研究结果表明,增强MEF2活性有助于预防痴呆。然而,研究人员说,由于MEF2也会影响其他类型的细胞和细胞过程,需要进行更多的研究,以确保激活它不会产生不良副作用。
麻省理工学院的研究小组现在希望进一步研究MEF2是如何通过暴露在丰富的环境中而被激活的。除了在本研究中探索的离子通道外,他们还计划研究MEF2控制的其他基因的一些影响。这类研究有助于揭示药物治疗的额外目标。
Raju说:“你可以通过识别对诱导恢复力和神经保护至关重要的转录因子的子集,来期待一种更有针对性的治疗。”
“MEF2 is a key regulator of cognitive potential and confers resilience to neurodegeneration” by Scarlett J. Barker, Ravikiran M. Raju, Noah E.p. Milman, Jun Wang, Jose Davila-Velderrain, Fatima Gunter-Rahman, Cameron C. parro, p. Lorenzo Bozzelli, Fatema Abdurrob, Karim Abdelaal, David A. Bennett, Manolis Kellis and Li-Huei Tsai, 3 November 2021, Science Translational Medicine.
DOI: 10.1126/scitranslmed.abd7695






























